题目内容
 以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )分析:A、从蛋白质的性质分析;
B、负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+;
C、根据电池的电极反应知识来回答;
D、根据正负极电极反应式结合电子守恒原理进行计算.
B、负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+;
C、根据电池的电极反应知识来回答;
D、根据正负极电极反应式结合电子守恒原理进行计算.
解答:解:A、高温条件下微生物会变性,该电池不能够在高温下工作,故A错误;
B、负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+,故B正确;
C、向装置中加入适量的NaOH溶液,会和氢离子以及二氧化碳发生反应,会使得电解质发生变化,故C错误;
D、正极反应式为O2+4e-+4H+═2H2O,对比负极反应可知,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,故D错误;
故选B.
B、负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+,故B正确;
C、向装置中加入适量的NaOH溶液,会和氢离子以及二氧化碳发生反应,会使得电解质发生变化,故C错误;
D、正极反应式为O2+4e-+4H+═2H2O,对比负极反应可知,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,故D错误;
故选B.
点评:本题从两个角度考查①原电池反应(反应原理、电极方程式的书写、离子的移动方向);②有关化学方程式的计算.

练习册系列答案
相关题目
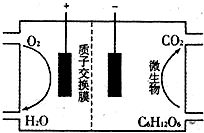 微生物燃料电池(MicrobialFuelCell,MFC)是利用微生物将有机物中的化学燃料能直接转化成电能的装置.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )
微生物燃料电池(MicrobialFuelCell,MFC)是利用微生物将有机物中的化学燃料能直接转化成电能的装置.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )| A、电池介质可能为强碱性溶液 | B、电池的负极反应为:C6H12O6+6H2O-24e-?6CO2↑+24H+ | C、电池工作时,H+从正极区通过质子交换膜向负极区迁移 | D、在电池反应中,每消耗1 mol氧气,就生成22.4L的CO2气体 |


 .
.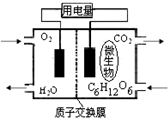 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )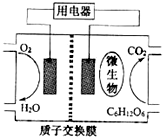 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )