题目内容
下列有关叙述正确的是
| A.因为液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 |
| B.NaHCO3晶体中阳离子和阴离子的个数比为1∶1 |
| C.CO2和SiO2都是共价化合物,两种晶体熔化时克服粒子间作用力类型相同 |
| D.强弱电解质的判断依据是其水溶液导电能力的大小 |
B
略

练习册系列答案
相关题目
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据

 电子数相同的微粒的化学式 、
电子数相同的微粒的化学式 、
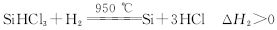 关于上述条件下两个反应的叙述中不正确的是______________。
关于上述条件下两个反应的叙述中不正确的是______________。
 C(金刚石) ΔH=+19 kJ·mol-1可知,金刚石比石墨稳定
C(金刚石) ΔH=+19 kJ·mol-1可知,金刚石比石墨稳定 (g)====H2O(l) ΔH=+285.8 kJ·mol-1
(g)====H2O(l) ΔH=+285.8 kJ·mol-1 ⑧
⑧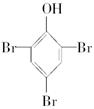


 中一定正确的是( )
中一定正确的是( )