题目内容
如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)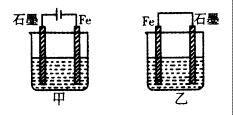
| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
B
解析试题分析:根据题意知,甲装置为电解池,石墨作阳极,电极反应式为4OH- - 4e- =O2↑ + 2H2O,铁作阴极,电极反应式为2H+ + 2e-= H2↑;乙装置为原电池,铁作负极,电极反应式为Fe - 2e-=Fe2+,石墨作正极,电极反应式为2H+ + 2e-= H2↑;A、甲为阴极电保护法,乙为钢铁的析氢腐蚀,铁棒的腐蚀程度:甲<乙,正确;B、碳电极上发生反应的电极反应式不同,错误;C、甲为电解水装置,硫酸的浓度增大,PH减小,乙的电池反应为2H+ + Fe= H2↑+Fe2+,溶液的pH增大,正确;D、根据电极反应式计算,甲乙产生气体的体积(相同条件)比为3:2,正确。
考点:考查原电池原理和电解原理的应用。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某种聚合物锂离子电池放电时的反应为Lil-xCoO2+LixC6=6C+LiCoO2,其电池如图所示。下列说法不正确的是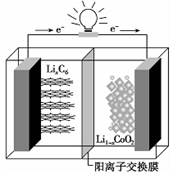
| A.放电时,LixC6发生氧化反应 |
| B.充电时,Li+通过阳离子交换膜从左向右移动 |
| C.充电时,将电池的负极与外接电源的负极相连 |
| D.放电时,电池的正极反应为Lil-xCoO2+xLi++ xe-=LiCoO2 |
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )
| A.原电池放电时,负极上发生反应的物质是Zn |
| B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2 |
| C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强 |
| D.溶液中OH-向正极移动,K+、H+向负极移动 |
电解原理在化学工业中有着广泛的应用。图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。则下列说法不正确的是( )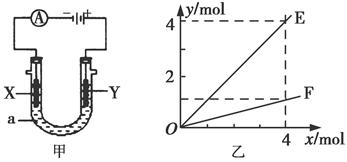
| A.若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 |
| B.按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 |
| C.按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol |
| D.若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol·L-1 |
一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )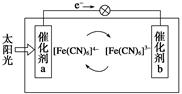
| A.K+移向催化剂b |
| B.催化剂a表面发生的化学反应:[Fe(CN)6]4--e-=[Fe(CN)6]3- |
| C.Fe(CN)63-在催化剂b表面被氧化 |
| D.电解池溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变 |
氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为:O2+2CO2+4e-=2C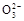 。下列叙述正确的是( )
。下列叙述正确的是( )
A.放电时C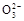 向正极移动 向正极移动 |
| B.放电时OH-向负极移动 |
C.负极反应为H2+C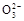 -2e-=H2O+CO2 -2e-=H2O+CO2 |
| D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L时,转移电子4 mol |
如图装置中,小试管内为红墨水,带有支管的U形管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U形管中的液面。以下有关解释合理的是( )
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH- |
| D.U形管中溶液pH逐渐减小 |
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )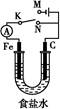
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是:4OH--4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH |
图甲中电极均为石墨电极,下列叙述中正确的是( )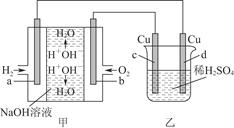
| A.电子沿a→d→c→d路径流动 |
| B.b极的电极反应为O2+4e-+4H+=2H2O |
C.通电初期乙中的总反应为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| D.反应过程中,甲、乙装置中溶液的pH都逐渐减小 |