题目内容
常温下,0.1mol/L氨水溶液中 =1×10-8,下列叙述不正确的是
=1×10-8,下列叙述不正确的是
A.该溶液中氢离子的浓度:c(H+)=1×10-11mol/L
B.0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合后所得溶液中:c(NH+4)+c(H+)=c(Cl—)+c(OH+)
C.0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合后所得溶液中:c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4)
D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
【答案】
D
【解析】
试题分析:A、常温下,0.1mol/L氨水溶液中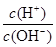 =1×10-8,则根据水的离子积常数c(H+)·c(OH-)=1×10-14可知,溶液中c(H+)=
=1×10-8,则根据水的离子积常数c(H+)·c(OH-)=1×10-14可知,溶液中c(H+)=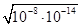 =1×10-11mol/L,A正确;B、0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合,二者恰好反应生成氯化铵,根据电荷守恒可知,溶液中c(NH4+)+c(H+)=c(OH-)+c(Cl-),B正确;C、0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合,二者恰好反应生成硫酸铵,根据物料守恒可知c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4),C正确;D、浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,这说明氨水的电离程度大于NH4+的水解程度,所以溶液中c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+),D不正确,答案选D。
=1×10-11mol/L,A正确;B、0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合,二者恰好反应生成氯化铵,根据电荷守恒可知,溶液中c(NH4+)+c(H+)=c(OH-)+c(Cl-),B正确;C、0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合,二者恰好反应生成硫酸铵,根据物料守恒可知c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4),C正确;D、浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,这说明氨水的电离程度大于NH4+的水解程度,所以溶液中c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+),D不正确,答案选D。
考点:考查弱电解质的电离平衡、盐类水解以及溶液中离子浓度大小比较等

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:2Cu2O+Cu2S
6Cu+SO2↑.
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol?L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3) c(SO32-)(填“>”、“=”或“<”),原因是 .
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中 作阴极.
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
在25℃下,向浓度均为0.1mol?L-1的FeCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 .
| ||
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol?L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3)
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×-20 | 4.0×10-38 |