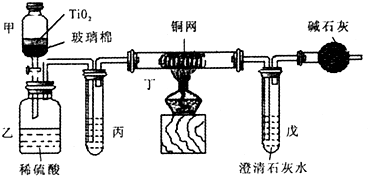
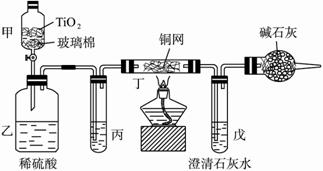
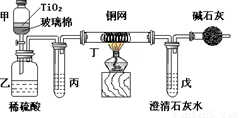
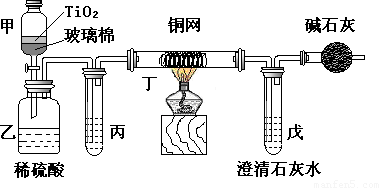
题目内容
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液200 mL(其中CN-的浓度为0.05 mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
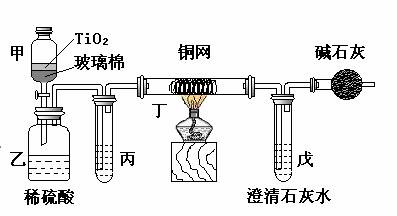
(1) 甲中反应的离子方程式为_______________;乙中反应的离子方程式为________
(2) 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。丙中加入的除杂试剂是____________(填字母)
a.饱和食盐水 b.饱和NaHCO3溶液
c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是__________________________________
(4)戊中盛有足量的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于_________________。请说明该测得值与实际处理的百分率相比偏高还是偏低?简要说明理由______________________________。
(1) CN-+ClO-![]() CNO-+Cl-;
CNO-+Cl-;
2CNO-+2H+ +3ClO-![]() N2↑+2CO2↑+3Cl-+H2O
N2↑+2CO2↑+3Cl-+H2O
(2)a;
(3)去除Cl2;
(4)82%;偏低,因为在丙中溶解的CO2以及装置中滞留的CO2未与戊中的澄清石灰水反应。