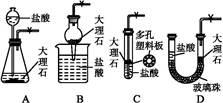
题目内容
下列药品和装置合理且能完成相应实验的是( )

| A.喷泉实验 |
| B.实验室制取并收集氨气 |
| C.制备氢氧化亚铁 |
| D.验证苯中是否有碳碳双键 |
D
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ = Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。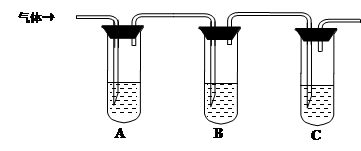
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案。
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 | 若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO + Na2SO3 = NaCl+ Na2SO4 ;
2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
下列有关实验装置进行的相应实验,能达到实验目的的是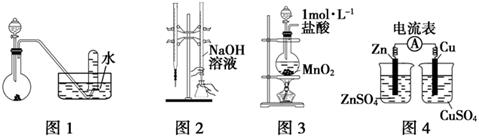
| A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO |
| B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 |
| C.用图3所示装置制取少量Cl2 |
| D.用图4所示装置检验电流的方向 |
下列有关实验装置的说法中正确的是

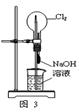
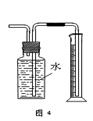
| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
下列气体中,既可用浓硫酸干燥,又可用固体氢氧化钠干燥的是
| A.Cl2 | B.SO2 | C.H2 | D.NH3 |
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
| A.a-b-c-d-e-e-f-g-h | B.a-e-d-c-b-h-i-g | C.a-d-e-c-b-h-i-g | D.a-c-b-d-e-h-i-f |
实验桌上只有烧碱、盐酸、铜片、大理石、蒸馏水五种试剂,从欠缺试剂的角度来看(实验仪器齐全),无法进行的实验项目是( )
| A.制取氢气 | B.制取碳酸钠 | C.制取氯化铜 | D.测定盐酸的浓度 |
在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:
(1)Fe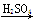 H2
H2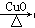 Cu
Cu
(2)CuO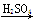 CuSO4
CuSO4 Cu
Cu
若用这两种方法制得等量的铜,则下列有关说法符合实际情况的是( )
| A.消耗铁的质量相同 |
| B.消耗硫酸的质量相同 |
| C.生成硫酸亚铁的质量相同 |
| D.消耗氧化铜的质量相同 |