题目内容
工业上生产硫酸的流程图如下:

请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是 。
(2)在气体进入催化反应室前需净化的原因是 。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以 ,从而提高生产效率 。
(4)工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理: 。
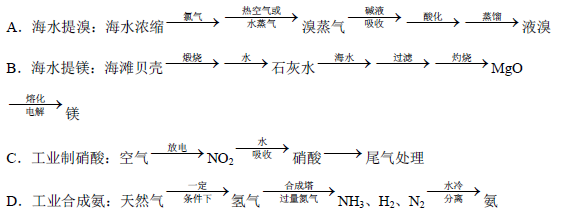
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是 。

请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是 。
(2)在气体进入催化反应室前需净化的原因是 。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以 ,从而提高生产效率 。
(4)工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理: 。
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是 。

(1)以黄铁矿为原料的生产中产生的废弃物太多,处理成本高(2)防止催化剂中毒(3)使平衡向正方向移动;有利于提高SO2的转化率(4)SO2+NH3+H2O=NH4HSO3;NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2↑或SO2+2NH3+H2O=(NH4)2SO3;(NH4)2SO3+H2SO4=(NH4)2SO4+H2O+SO2↑(5)A D
试题分析:(1)黄铁矿的主要成分为FeS2,以黄铁矿为原料的生产中产生的废弃物太多,处理成本高使得现在工厂生产硫酸以硫黄为原料(2)以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收;其中二氧化硫的催化氧化在催化剂表面和空气中的氧气接触反应,若气体中含有杂质气体容易使催化剂中毒,所以煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥;故答案为:接触室,防止催化剂中毒(3)由题意知反应方程式2SO2(g)+O2(g)
 2SO3(g),在常压下,SO2的转化率约为90%,采用高压条件,可以使化学反应速率加快,并且化学平衡向着生成三氧化硫的方向进行,可以提高生产效率,提高经济效益,故答案为使平衡向正方向移动;有利于提高SO2的转化率(4)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理,先用氨水吸收时,发生反应:SO2+2NH3?H2O═(NH4)2SO3或SO2+2NH3+H2O=(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O或(NH4)2SO3+H2SO4=(NH4)2SO4+H2O+SO2↑,以达到消除污染、废物利用的目的(5)A、海水提溴的方法正确;B、海水提镁主要通过电解氯化镁完成,基本流程如下:海水-(结晶)-母液-(石灰乳)-Mg(OH)2-(加盐酸,浓缩,结晶)-MgCl2晶体-(脱水)-MgCl2-(电解)-Mg,故B错误;C、空气放电生成二氧化氮反应成本太高而且产物不稳定,工业制硝酸主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸,故C错误;D、工业制备氨气流程正确;故答案为A D。
2SO3(g),在常压下,SO2的转化率约为90%,采用高压条件,可以使化学反应速率加快,并且化学平衡向着生成三氧化硫的方向进行,可以提高生产效率,提高经济效益,故答案为使平衡向正方向移动;有利于提高SO2的转化率(4)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理,先用氨水吸收时,发生反应:SO2+2NH3?H2O═(NH4)2SO3或SO2+2NH3+H2O=(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O或(NH4)2SO3+H2SO4=(NH4)2SO4+H2O+SO2↑,以达到消除污染、废物利用的目的(5)A、海水提溴的方法正确;B、海水提镁主要通过电解氯化镁完成,基本流程如下:海水-(结晶)-母液-(石灰乳)-Mg(OH)2-(加盐酸,浓缩,结晶)-MgCl2晶体-(脱水)-MgCl2-(电解)-Mg,故B错误;C、空气放电生成二氧化氮反应成本太高而且产物不稳定,工业制硝酸主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸,故C错误;D、工业制备氨气流程正确;故答案为A D。
练习册系列答案
相关题目
 2 NH3
2 NH3 2SO3(g) ΔH<0。经过相同的反应时间后,分别测定五个容器中SO2的转化率(α),并作出其随反应温度(T)变化的关系图。下列示意图中,不可能与实验结果相符的是( )
2SO3(g) ΔH<0。经过相同的反应时间后,分别测定五个容器中SO2的转化率(α),并作出其随反应温度(T)变化的关系图。下列示意图中,不可能与实验结果相符的是( )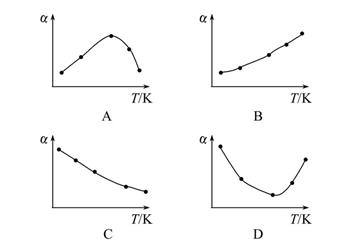
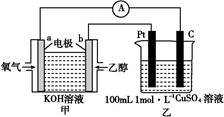
 CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
 是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是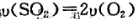 B.容器内压强保持不变.
B.容器内压强保持不变. D.容器内物质的密度保持不变.
D.容器内物质的密度保持不变.
 CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下一定达到最大限度的是