题目内容
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
①湿法制备的主要反应方程式为:Fe(OH)3+ ClO—+ OH— → FeO42—+ Cl—+ H2O
②干法制备的主要反应方程式为: FeSO4+ Na2O2 → Na2FeO4+ Na2O+ Na2SO4 + O2↑
(均未配平)
下列有关说法不正确的是
①湿法制备的主要反应方程式为:Fe(OH)3+ ClO—+ OH— → FeO42—+ Cl—+ H2O
②干法制备的主要反应方程式为: FeSO4+ Na2O2 → Na2FeO4+ Na2O+ Na2SO4 + O2↑
(均未配平)
下列有关说法不正确的是
| A.高铁酸钠中铁显+6价 |
| B.湿法制备的反应方程式中,氧化剂和还原剂的物质的量之比为3∶2 |
| C.干法中每生成1 mol Na2FeO4转移4 mol电子 |
| D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
C
根据化合物中正负价的代数和为0可知,铁的化合价是+(2×4-1×2)=+6价,A正确。反应①中氧化剂是ClO—,氯原子的化合价由+1价降低-1价,变化2个单位。还原剂是Fe(OH)3,铁的化合价由+3价升高到+6价,变化3个单位。根据得失电子守恒可知,氧化剂和还原剂的物质的量之比为3∶2,B正确。反应②氧化产物不止Na2FeO4,还有氧气,所以每生成1 mol Na2FeO4转移电子的物质的量大于4 mol,C是错误的。K2FeO4中铁的化合价是+6价的,具有氢氧化性,还原产物铁离子能水解生成氢氧化铁胶体具有吸附性,D正确。答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
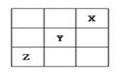
 ,关于此反应的叙述正确的是( )
,关于此反应的叙述正确的是( )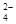 和Cr2O
和Cr2O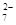 中Cr元素的化合价相同。
中Cr元素的化合价相同。