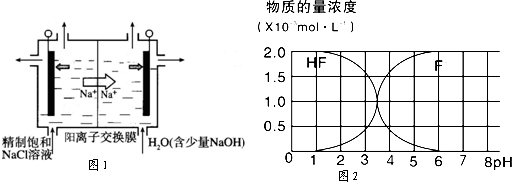
题目内容
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。

(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
① ;② ;③洗涤;④干燥。
(4)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 →Na2S4O6 + 2NaI)
(5)判断滴定终点的现象 。原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
(1)2KClO3+ H2C2O4  K2CO3+CO2↑+2ClO2↑+H2O
(2分)
K2CO3+CO2↑+2ClO2↑+H2O
(2分)
(2)温度计 冰水浴 (2分)
(3)蒸发结晶 趁热过滤 (2分)
(4)根据氧化还原反应过程中电子转移守恒,反应整个过程中氯元素最终为-1价,所以FeSO4所失去的电子数相等,消耗的FeSO4的量也相等。 (2分)
(5)加到最后一滴时,溶液的颜色突然由蓝色变为无色,且半分钟不变化(2分) 135cV2/V1(2分)
【解析】
试题分析:(1)A中反应产物有K2CO3、ClO2和CO2等,加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水,反应方程式为:2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O;
(2)要控制温度必须使用温度计测量温度,在60℃时反应制得,应用水浴加热,可用烧杯(或水浴锅),二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行,所以应该采用冰水浴,故答案为:冰水浴; 烧杯(或水浴锅),温度计;
(3)根据信息NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,随着温度升高溶解度增大,因此请补充从NaClO2溶液中制得NaClO2的操作步骤为蒸发结晶和趁热过滤。
(4)根据氧化还原反应过程中电子转移守恒,反应整个过程中氯元素最终为-1价,所以FeSO4所失去的电子数相等,消耗的FeSO4的量也相等。
(5)判断滴定终点的现象为滴定终点时,I2完全反应,溶液由蓝色变为无色,故答案为:蓝色变为无色且半分钟不变化;
(6)设原ClO2溶液的浓度为x,
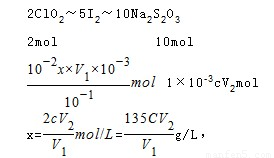
考点:本题考查了实验方案的设计,同时考查学生分析问题、解决问题的能力,明确物质的性质是解本题关键,难度较大。

 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.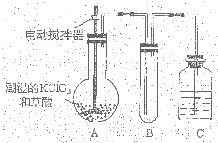 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题: