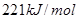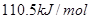题目内容
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
下列说法中正确的是
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,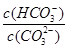 减小
减小
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 8.4 | 11.6 | 11.1 |
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,
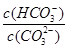 减小
减小C
阳离子均为Na+和H+,Na2CO3溶液中Na+浓度是其他两种的两倍,阳离子浓度最大,NaCN溶液和NaHCO3溶泼中Na+浓度相等, NaCN溶液中H+浓度小于NaHCO3溶液,故阳离子浓度大小顺序为Na2CO3 > NaHCO3 >NaCN,A项错误;HCO3-的水解能力小于CN-,故酸性:H2CO3>HCN,B项错误;升高Na2CO3溶液的温度,促进其水解,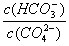 增大,D项错误,答案选C。
增大,D项错误,答案选C。
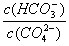 增大,D项错误,答案选C。
增大,D项错误,答案选C。
练习册系列答案
相关题目

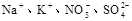
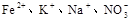
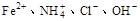
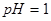 的溶液中,
的溶液中,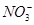 、
、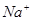 、
、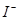 、
、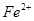
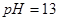 的溶液中,
的溶液中, 、
、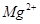 、
、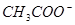 、
、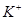
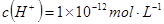 溶液中,
溶液中,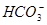 、
、 、
、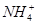
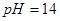 的无色透明溶液中,
的无色透明溶液中,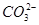
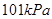 时,
时,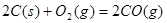 ;
;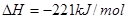
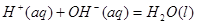 ;
;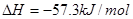
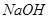 溶液反应生成
溶液反应生成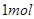 水,放出
水,放出 热量
热量