题目内容
制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还原剂之比为( )A.1:1
B.1:2
C.2:1
D.3:2
【答案】分析:在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,还原产物是氯化钠;氯气中氯元素化合价由0价升高为+1价,氯气是还原剂,氧化产物是次氯酸钠.根据产物可知起氧化剂与还原剂的氯气各占一半.据此解答.
解答:解:在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,氯元素被还原,还原产物是氯化钠;氯气中氯元素化合价由0价升高为+1价,氯气是还原剂,氯元素被氧化,氧化产物是次氯酸钠.根据产物中氯原子化合价变化,可知起氧化剂与还原剂的氯气各占一半,所以反应的氧化剂与还原剂之比为1:1.
故选A.
点评:本题考查氧化还原反应概念及计算,难度不大,判断氧化剂、还原剂后,可以根据电子转移守恒计算氧化剂和还原剂的物质的量之比.
解答:解:在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,氯元素被还原,还原产物是氯化钠;氯气中氯元素化合价由0价升高为+1价,氯气是还原剂,氯元素被氧化,氧化产物是次氯酸钠.根据产物中氯原子化合价变化,可知起氧化剂与还原剂的氯气各占一半,所以反应的氧化剂与还原剂之比为1:1.
故选A.
点评:本题考查氧化还原反应概念及计算,难度不大,判断氧化剂、还原剂后,可以根据电子转移守恒计算氧化剂和还原剂的物质的量之比.

练习册系列答案
相关题目
(08潮阳一中模拟)(15分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列实验没有错误的是 。

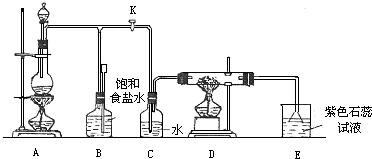
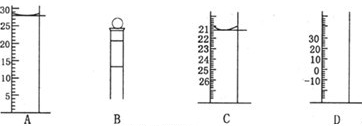
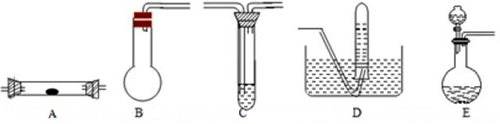
(2)下图为常见仪器的部分结构(有的仪器被放大)


A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
(3)化学研究小组,通过网上查找资料发现,Cl2的制取有下列不同方案:
![]() 方案:加热条件下二氧化锰与浓盐酸反应制得Cl2
方案:加热条件下二氧化锰与浓盐酸反应制得Cl2
![]() 方案:浓盐酸与氯酸钾固体反应制得Cl2
方案:浓盐酸与氯酸钾固体反应制得Cl2
![]() 方案:电解饱和食盐水法制得Cl2
方案:电解饱和食盐水法制得Cl2
现实验室有供选择的如下几种仪器来制取Cl2
 | |||||||
 | |||||||
 | |||||||
 |  | ||||||
①用上述仪器不能实现的方案为 。不考虑固定装置的仪器,可行但缺仪器的方案是 ,所缺的仪器是 。
若按b方案制Cl2时发生化学方程为_________________,
②若要设计联合实验探究氯气的漂白原理,从制备装置中产生氯气后应连接的装置中所使用的试剂或用品依次是____。