题目内容
(1)右图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量筒中液体的体积是________mL。
(2)右图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL B.是(50-a)mL
C. 一定大于amL D.一定大于(50-a)mL
(3)右图Ⅲ为20mL未知浓度的盐酸用一标准浓度NaOH溶液滴定时的滴定曲线。则两种溶液的物质的量浓度分别是:
[HCl]= ,[NaOH]= 。
(1)3.2 (2)D (3)1mol/L,0.5mol/L

 轻松暑假总复习系列答案
轻松暑假总复习系列答案(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g),其化学平衡常数K与t的关系如下表:
| t/K | 298 | 398 | 498 | …… |
| K/(mol·L—1)—2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl—)>c(N2H62+)>c(H+)>c(OH—)
B.c(Cl—)>c([N2H5·H2O]+)>c(OH—)>c(H+)
C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) =c(Cl—)+c(OH—)
D.c(N2H62+) > c(Cl—)> c(H+)>c(OH—)
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO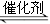 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
|
时间(s) |
0 |
2 |
4 |
|
c(NO) ( mol·L-1) |
1.00×10-3 |
2.50×10-4 |
1.00×10-4 |
|
c(CO) ( mol·L-1) |
3.60×10-3 |
c’ |
2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是

A. B. C. D.
 物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向1L正庚烷中加入(t-BuNO)20.50mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1L).下列说法正确的是( )
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向1L正庚烷中加入(t-BuNO)20.50mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1L).下列说法正确的是( ) 2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
 2NO (g),该反应是导致汽车尾气中含有NO的原因之一。
2NO (g),该反应是导致汽车尾气中含有NO的原因之一。