题目内容
下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是
A.C≡C键能为796.0 kJ/mol
B.C—H键键长小于H—H键
C.2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是
A.C≡C键能为796.0 kJ/mol
B.C—H键键长小于H—H键
C.2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
A
试题分析: B.由于C原子半径比H大,所以C—H键键长大于H—H键。错误。C. H2燃烧热285.8 kJ/mol是指1mol H2完全燃烧产生稳定的化合物时放出的热量。H2O的稳定状态为液态。正确的应该为2H2(g) +O2(g)= 2H2O(l) △H=﹣571.6 kJ/mol.错误。D.假设反应2CH4(g)= C2H2(g) +3H2(g) 的反应热为△H,则根据盖斯定律可得-2×890.3=△H-1299.6-3×285.8。解得△H=+376.4。所以2CH4(g)=C2H2(g) +3H2(g) △H="+376.4" kJ/mol。错误。A. 根据键能与反应热的关系,结合热化学方程式2CH4(g)=C2H2(g) +3H2(g) △H="+376.4" kJ/mol可得8×413.4-2×413.4-C≡C-3×436.0=376.4。解得C≡C的键能为796.0。因此选项A正确。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
 H2O(l) 的 ΔH =" —40.69" kJ·mol-1
H2O(l) 的 ΔH =" —40.69" kJ·mol-1 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1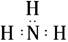 (NH3)
(NH3)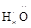 ∶∶
∶∶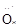 H(H2O2)
H(H2O2)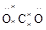 ∶(CO2)
∶(CO2)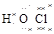 (HClO)
(HClO)