题目内容
将0.2 mol MnO2和50mL 12mol/L盐酸混合后加热使其充分反应,反应完全后,向反应后的溶液中加入足量的AgNO3溶液 ,生成AgCl沉淀的物质的量是(不考虑盐酸的挥发)
| A.小于0.3mol | B.等于0.3mol |
| C.大于0.3mol,小于0.6mol | D.等于0.6mol |
C
分析:MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,以此解答该题.
解:反应的化学方程式为MnO2+4HCl(浓)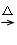 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
n(MnO2)=0.2mol,n(HCl)=0.05L×12mol/L=0.6mol,
根据方程式可知MnO2过量,如盐酸完全反应,则生成0.3molCl2,溶液剩余0.3molCl-,但MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,所以溶液中溶液剩余Cl-大于0.3mol,
所以,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量大于0.3mol,小于0.6mol,
故选C.
点评:本题考查浓盐酸与二氧化锰反应的性质,题目难度不大,注意MnO2只与浓盐酸反应.
解:反应的化学方程式为MnO2+4HCl(浓)
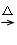 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,n(MnO2)=0.2mol,n(HCl)=0.05L×12mol/L=0.6mol,
根据方程式可知MnO2过量,如盐酸完全反应,则生成0.3molCl2,溶液剩余0.3molCl-,但MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,所以溶液中溶液剩余Cl-大于0.3mol,
所以,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量大于0.3mol,小于0.6mol,
故选C.
点评:本题考查浓盐酸与二氧化锰反应的性质,题目难度不大,注意MnO2只与浓盐酸反应.

练习册系列答案
相关题目