题目内容
如右图所示,常温下电解5 min后,铜电极质量增加2.16g。
 试回答:
试回答:
(1)电源电极X名称为 (填“正极”或“负极”),B中 铜电极的名称 。
(2)电解池B中阳极的电极反应式是 。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
PH= (忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解前完全相同,应
加入 。
(1)负极 ,阴极(2)Ag++e-=Ag (3)13 ,HCl
解析:
(1)据题意铜电极质量增加,可说明银离子在此电极上析出,可推出铜电极是阴极,进一步推
出X的电极为负极。
(2)银电极为阳极,由于银为活性电极,故银本身失电子。
(3) 据B中阴极电极反应式:Ag++ e- = Ag ,显然当析出银的物质的量为0.02mol时,电子转移0.02mol,由A与B两池中转移电子式相等,结合电解KCl溶液的总反应式: 2Cl-+2H2O![]() C12↑+ H2↑+ 2OH-,可推出OH-的物质的量等于转移电子的物质的量,即n(OH-)为0.02mol,c(OH-)=0.1mol,由水的离子积常数随之推出c(H+) ,随之求解PH。要使电解后的溶液恢复到与电解前完全相同,其规律是加入将从电极上析出的单质通过化合反应生成的物质即可复原。
C12↑+ H2↑+ 2OH-,可推出OH-的物质的量等于转移电子的物质的量,即n(OH-)为0.02mol,c(OH-)=0.1mol,由水的离子积常数随之推出c(H+) ,随之求解PH。要使电解后的溶液恢复到与电解前完全相同,其规律是加入将从电极上析出的单质通过化合反应生成的物质即可复原。

(15分)
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
|
元素 |
性质或结构信息 |
|
X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
|
Y |
二价阳离子的外围电子层排布为3d9 |
|
T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
|
Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
⑴ 写出 X3- 的一种等电子体的化学式 ; X的气态氢化物易液化的原因是: 。
⑵写出T元素基态原子的核外电子排布图 ;
Q元素的原子核外有 种运动状态不同的电子。
⑶元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
⑷甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
⑸Y元素在周期表中位于 区。Y单质晶体的晶胞如右图所示,
该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的
堆积方式为 堆积。

⑹在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
⑺元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大。已知X是迄今为止形成化合物最多的元素。Y原子最外层电子数与核外电子总数之比为
3∶4。M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物。Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小。W是第Ⅷ族元素中原子序数最小的元素。据此回答:
(1)写出N在周期表中的位置: ,化学键X—N的类型:
(填“离子键”、“极性共价键”或“非极性共价键);
(2)用电子式表示Z与M形成化合物的过程 ;
(3)X、Y、M的电负性由小到大的顺序是 ;N3一与X、Y形成的一种化合物互为等电子体,则N3一的空间构型为 ;
|
 |
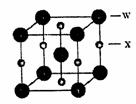
(5)X和W所形成的某种晶体结构如右图所示,写出:
基态W2+离子的价电子排布式 ;该晶体的化学式 。

 阴极获得钛可能发生的反应或电极反应为:
阴极获得钛可能发生的反应或电极反应为: ,下列说法正确的是
,下列说法正确的是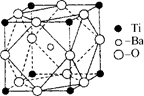

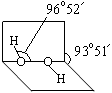
 R(OH)3
R(OH)3 
 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。