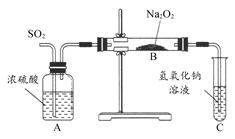
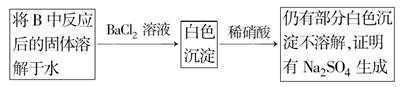
题目内容
要测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数可采取不同的方法,取a克样品与一定量稀盐酸(过量)充分反应后,下列说法正确的是
| A.逸出气体若用碱石灰吸收,增重b克。则测定混合物中Na2CO3的质量分数偏小 |
| B.把所得溶液加热蒸干,并灼烧至恒重,得b克固体。蒸干过程中若未搅拌,则所测Na2CO3的质量分数可能偏大 |
| C.某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂,仍用此碱液滴定上述反应后的溶液,则所测Na2CO3的质量分数偏大 |
| D.产生的气体冷却至室温后,若测定其体积时忘记调平量气管和水准管内液面,则导致Na2CO3的质量分数偏小 |
A
试题分析:Na2CO3和NaHCO3与HCl反应的方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;NaHCO3+HCl= NaCl+H2O+ CO2↑。可见,等质量的Na2CO3和NaHCO3,NaHCO3产生的CO2多。A.由于逸出气体中含有水蒸汽,若用碱石灰吸收,增重的质量还含有水蒸汽的质量。碱石灰增加的质量越多,根据其数值计算的CO2就多,NaHCO3含量就越高,因此测定混合物中Na2CO3的质量分数偏小。正确。B.在加热蒸干后得到的固体中含Na2CO3和NaHCO3。灼烧时发生分解反应2NaHCO3
 Na2CO3+CO2↑+H2O。蒸干过程中即使未搅拌,在灼烧时也会把结晶水及溶剂水蒸发掉,所以对所测Na2CO3的质量分数无影响。错误。C.某NaOH标准溶液露置于空气,会有一部分发生反应:CO2+2NaOH=Na2CO3+H2O。若以甲基橙为指示剂,由于它的变色点为4.4,此时Na2CO3、NaOH都会与HCl发生反应,所以对所测Na2CO3的质量分数无影响。错误。D. 若测定其体积时忘记调平量气管和水准管内液面,则V(CO2)偏小,NaHCO3含量就偏少,故导致Na2CO3的质量分数偏大。错误。2CO3和NaHCO3的性质及各种实验方法测定含量的误差分析的知识。
Na2CO3+CO2↑+H2O。蒸干过程中即使未搅拌,在灼烧时也会把结晶水及溶剂水蒸发掉,所以对所测Na2CO3的质量分数无影响。错误。C.某NaOH标准溶液露置于空气,会有一部分发生反应:CO2+2NaOH=Na2CO3+H2O。若以甲基橙为指示剂,由于它的变色点为4.4,此时Na2CO3、NaOH都会与HCl发生反应,所以对所测Na2CO3的质量分数无影响。错误。D. 若测定其体积时忘记调平量气管和水准管内液面,则V(CO2)偏小,NaHCO3含量就偏少,故导致Na2CO3的质量分数偏大。错误。2CO3和NaHCO3的性质及各种实验方法测定含量的误差分析的知识。
练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
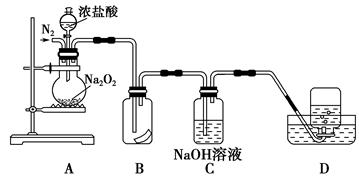
 Na2O2+
Na2O2+