题目内容
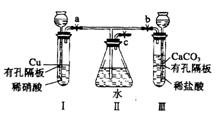
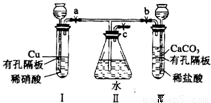
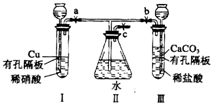 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.(1)如果开启a和c,关闭b,则I中反应的离子方程式为
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(2)如果将I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,过一会儿观察,可以看到II里浸入水中的导管口有气泡冒出,导管内气体呈
红棕
红棕
色,液面上气体为无
无
色.(3)在问题(1)的实验中,要使II里的气体始终保持无色,应先关闭
a
a
(填a或b,下同),开启b
b
和c,使产生的CO2气体排尽II里的空气,再关闭b
b
打开a
a
.(4)若将32g铜加入盛有150mL一定浓度硝酸的I中使之恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L.则NO为
0.25
0.25
mol.原硝酸溶液的浓度为10
10
mol?L-1.分析:(1)开启a和c,关闭b,装置中压强减小,长颈漏斗中硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜一氧化氮和水;
(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;
(3)始终保持无色,装置Ⅱ中不能含有空气,需要Ⅲ反应生成二氧化碳把装置Ⅱ中的空气赶净,生成的二氧化氮与水反应生成无色气体;
(4)根据化学方程式计算,可以利用氧化还原反应的电子守恒列式计算.
(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;
(3)始终保持无色,装置Ⅱ中不能含有空气,需要Ⅲ反应生成二氧化碳把装置Ⅱ中的空气赶净,生成的二氧化氮与水反应生成无色气体;
(4)根据化学方程式计算,可以利用氧化还原反应的电子守恒列式计算.
解答:解:(1)开启a和c,关闭b,装置中压强减小,长颈漏斗中硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜一氧化氮和水;反应的化学方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;导管内气体呈红棕色,液面上气体是无色,故答案为:红棕;无;
(3)在问题(1)的实验中,要使II里的气体始终保持无色,应先关闭a,开启b和c,使产生的CO2气体排尽II里的空气,再关闭 b打开a,二氧化碳环境中,一氧化氮不再反应,
故答案为:a;b;b;a;
(4)若将32g铜加入盛有150mL一定浓度硝酸的I中使之恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L物质的量为0.5mol;依据氧化还原反应的电子守恒计算,设生成NO物质的量为x,则NO2物质的量为0.5mol-x;失电子的铜物质的量为0.5mol,Cu~Cu2+~2e-;失电子总数为1mol;得电子的是硝酸分别为:
HNO3~NO~3e-;
x 3x
NO3~NO2~e-;
0.5-x 0.5-x
3x+0.5-x=1
x=0.25mol
依据氮元素守恒得到,原硝酸溶液中溶质物质的量=0.25 mol+(0.5-0.25)+0.5×2=1.5mol;原硝酸浓度=
=10mol/L,
故答案为:0.25;10.
(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;导管内气体呈红棕色,液面上气体是无色,故答案为:红棕;无;
(3)在问题(1)的实验中,要使II里的气体始终保持无色,应先关闭a,开启b和c,使产生的CO2气体排尽II里的空气,再关闭 b打开a,二氧化碳环境中,一氧化氮不再反应,
故答案为:a;b;b;a;
(4)若将32g铜加入盛有150mL一定浓度硝酸的I中使之恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L物质的量为0.5mol;依据氧化还原反应的电子守恒计算,设生成NO物质的量为x,则NO2物质的量为0.5mol-x;失电子的铜物质的量为0.5mol,Cu~Cu2+~2e-;失电子总数为1mol;得电子的是硝酸分别为:
HNO3~NO~3e-;
x 3x
NO3~NO2~e-;
0.5-x 0.5-x
3x+0.5-x=1
x=0.25mol
依据氮元素守恒得到,原硝酸溶液中溶质物质的量=0.25 mol+(0.5-0.25)+0.5×2=1.5mol;原硝酸浓度=
| 1.5mol |
| 0.15L |
故答案为:0.25;10.
点评:本题考查了硝酸性质的应用,实验装置的反应原理的应用分析,铜和稀硝酸、浓硝酸反应产物的性质判断和应用,氧化还原反应的电子守恒的计算应用,难度中等.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目

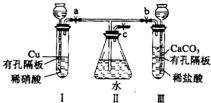 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.