题目内容
关于下列各图的叙述正确的是
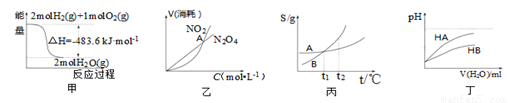
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2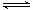 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
【答案】
D
【解析】
试题分析:A.标准燃烧热是1mol的物质完全燃烧产生稳定的化合物时放出的热量。题图给定的是2mol的氢气燃烧产生气态水时放出的热量。所以错误。B. 交点A对应的状态为NO2、N2O4浓度相等的状态,化学反应可能达到平衡,也可能没有达到平衡。错误。C. 将tl℃时A、B的溶解度相等。所以在这时饱和溶液的质量分数相同。若将饱和溶液分别升温至t2℃,由于溶质质量和溶剂质量不变,所以溶质的质量分数仍然相等。错误。D.由图可知:稀释相同的倍数HA的PH变化较大,说明酸性HA>HB。因此相同浓度的NaA、NaB溶液的的酸碱性比较,碱性NaB>NaA。即NaA溶液的pH小于同浓度的NaB溶液的pH。正确。
考点:考查图像法在化学反应、化学计算中的应用的知识。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
关于下列各图的叙述,正确的是( )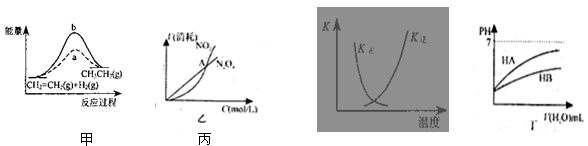
| A.图甲中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
B.图乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C.图丙中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| D.图丁中起始时HA的物质的量浓度大于HB |
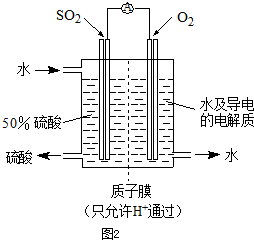

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态


