题目内容
当0.2mol Na218O2与足量CO2完全反应后,下列说法正确的是( )
| 生成Na2CO3质量 | 关于所生成O2的描述 | |
| A | 21.2g | O2的摩尔质量是36g?mol-1 |
| B | 21.6g | 生成的O2标况下的体积为2.24L |
| C | 21.2g | O2的摩尔质量是32g?mol-1 |
| D | 22.4g | 生成的标况下O2的体积为2.24L |
| A、A | B、B | C、C | D、D |
分析:Na218O2与CO2的反应实质是-1价的氧元素发生歧化反应,发生2Na218O2+2CO2═2Na2CO3+18O2,氧元素的化合价从-1价升高到0价,还有一部分氧元素化合价从-1价降到了-2价,该反应中转移电子是2mol,以此解答该题.
解答:解:当0.2mol Na218O2与足量CO2之间的反应为:2Na218O2+2CO2═2Na2CO3+18O2,该反应中转移电子是0.2mol,0.2mol碳酸钠即0.6mol氧中有0.2mol氧是18O,会生成碳酸钠0.2mol,即21.6g,氧气的摩尔质量是36g/mol,同时生成标况下氧气的物质的量是0.1mol,体积是2.24L.
故选:B.
故选:B.
点评:本题考查原子示踪法在化学反应中的应用,过氧化钠和二氧化碳的反应中,过氧化钠既是氧化剂又是还原剂,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义. 如图为室温下0.2mol/L CH3COOH溶液逐滴滴加到25.00mL 0.1mol/L NaOH溶液中pH的变化曲线(b点消耗的醋酸溶液的体积为12.5ml),下列说法正确的是( )
如图为室温下0.2mol/L CH3COOH溶液逐滴滴加到25.00mL 0.1mol/L NaOH溶液中pH的变化曲线(b点消耗的醋酸溶液的体积为12.5ml),下列说法正确的是( )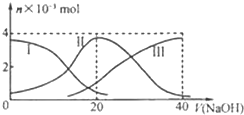 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )