题目内容
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:
a | |||||||||||||||||
b | d | e | |||||||||||||||
f | k | m | |||||||||||||||
n | p | ||||||||||||||||
(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界__________;
(2)表中最活泼的金属与最活泼的非金属形成的物质是_____________(填化学式);
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:__________,这两种化合物中所含的化学键有________(填序号);
A.极性共价键 B.非极性共价键 C.离子键
(4)e、f、k、m对应的单原子离子的半径由大到小的顺序为___________(填离子符号);
(5)d、m对应的离子还原性由强到弱顺序为__________________(填离子符号);
(6)d、e、m、p的气态氢化物中,最不稳定是___________(填分子式);
(7)用电子式表示n与m形成的原子个数比2:1的化合物的形成过程___________。
【答案】 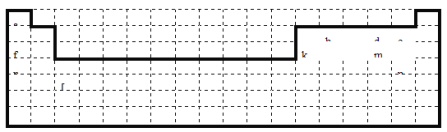 KF 2H2O2
KF 2H2O2![]() 2H2O + O2↑ AB S2->F- >Na+ >Al3+ S2->O2- H2S
2H2O + O2↑ AB S2->F- >Na+ >Al3+ S2->O2- H2S ![]()
【解析】(1). 元素周期表的上边界为短周期元素,第一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图所示: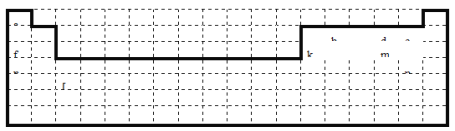 ,故答案如上表;
,故答案如上表;
(2). 由表中各元素所处的位置可知,a为H元素、b为C元素、d为O元素、e为F元素、f为Na元素、k为Al元素、m为S元素、n为K元素、p为Br元素,由元素周期律可知,表中最活泼的金属是K元素,最活泼的非金属是F元素,二者形成的物质是KF,故答案为:KF;
(3). a为H元素、d为O元素,二者可以形成H2O和H2O2两种化合物,H2O2可以分解生成H2O和O2,化学方程式为:2H2O2![]() 2H2O + O2↑,H2O中含有O-H极性共价键,H2O2中含有O-H极性共价键和O-O非极性共价键,二者均不含离子键,故答案为:2H2O2
2H2O + O2↑,H2O中含有O-H极性共价键,H2O2中含有O-H极性共价键和O-O非极性共价键,二者均不含离子键,故答案为:2H2O2![]() 2H2O + O2↑;AB;
2H2O + O2↑;AB;
(4). e为F元素、f为Na元素、k为Al元素、m为S元素,S2-有18个电子、三个电子层,离子半径最大,Na+、Al3+、F-均为10个电子,具有相同的核外电子排布,核外电子排布相同的离子,原子序数越大,离子半径越小,则离子半径由大到小的顺序为:S2->F- >Na+ >Al3+,故答案为:S2->F- >Na+ >Al3+;
(5). d为O元素、m为S元素,元素的非金属性O>S,则对应的离子还原性S2->O2-,故答案为:S2->O2-;
(6). d为O元素、e为F元素、m为S元素、p为Br元素,非金属性F>O>Br>S,元素的非金属性越强,气态氢化物越稳定,则最不稳定的气态氢化物是H2S,故答案为:H2S;
(7). n为K元素、m为S元素,二者形成的原子个数比为2:1的化合物是K2S,用电子式表示K2S形成过程的式子为:![]() ,故答案为:
,故答案为:![]() 。
。