题目内容
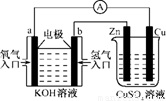
根据下图所示的装置,判断下列说法正确的是
- A.该装置中a极为负极
- B.当装置中某一块铜片的质量变化了12.8g时,a极上消耗O2在标准状况下的体积为4.48L
- C.该装置中b极的电极反应式是:H2-2e-=2H+
- D.一段时间后,左边装置中溶液pH减小
D
原电池中负极失去电子,正极得到电子,所以氢气在负极通入,氧气在正极通入,即a是正极,b是负极,A不正确。12.8g铜0.2mol,转移电子是0.4mol,所以根据电子得失守恒可知,消耗氧气是0.1mol,标准状况下的体积是2.24L,B不正确。原电池中电解质是氢氧化钠,负极反应式应该是H2-2e-+2OH-=2H2O,C不正确。选项D中生成水,氢氧化钠的浓度降低,pH减小,D正确,答案选D。
原电池中负极失去电子,正极得到电子,所以氢气在负极通入,氧气在正极通入,即a是正极,b是负极,A不正确。12.8g铜0.2mol,转移电子是0.4mol,所以根据电子得失守恒可知,消耗氧气是0.1mol,标准状况下的体积是2.24L,B不正确。原电池中电解质是氢氧化钠,负极反应式应该是H2-2e-+2OH-=2H2O,C不正确。选项D中生成水,氢氧化钠的浓度降低,pH减小,D正确,答案选D。

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
由化学能转变的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是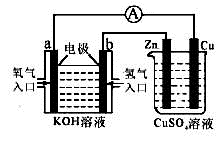
| A.该装置中Cu极为阳极 |
| B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
| C.该装置中b极的电极反应式是:H2+2OH--2e-===2H2O |
| D.该装置中a极为正极,发生氧化反应 |