题目内容
某地酸雨经检验,除
H+和OH-外,还含有Na+、Cl-、K+、SO42-,其物质的量浓度依次为c(Na+)=7.0×10-6 mol/L,c(Cl-)=3.5×10-5 mol/L,c(K+)=2.3×10-5 mol/L,c(SO42-)=2.5×10-6 mol/L,则该酸雨的pH为________.
答案:5
解析:
解析:
讲析:由溶液中离子电荷守恒可得阴、阳离子电荷相等关系式:
c(Na+)+c(K+)+c(H+)=2c(SO42-)+c(Cl-)+c(OH-),c(H+)=2×2.5×10-6 mol/L+3.5×10-5 mol/L+c(OH-)-7.0×10-6 mol/L-2.3×10-5 mol/L=1.0×10-5 mol/L,pH=5.(此处OH-浓度忽略不计)点评:本题利用电解质溶液中,阴离子电荷总数一定等于阳离子电荷总数,即电荷守恒巧妙解题,体现了理论联系实际、学以致用的理念.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
我国南方某地下了一场酸雨,经检验,酸雨中除H+和OH-以外,还含有Na+、Cl-、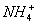 、
、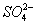 等,其物质的量浓度如下表所示:
等,其物质的量浓度如下表所示:
离子 | Na+ | Cl- |
|
|
物质的量浓度/mol·L-1 | 7.0×10-6 | 3.5×10-5 | 2.3×10-5 | 2.5×10-6 |
该酸雨中H+的物质的量浓度为__________。