题目内容
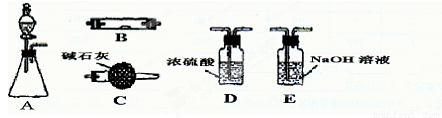
如图为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热及固定装置均略去),仪器装置可任意选用,必要时可重复选择,请完成:

(1)若装置A的锥形瓶中装锌片,分液漏斗中装稀硫酸,则可验证H2的还原性并检验其氧化产物.
①若按顺序A→D→B→B→C连接仪器装置时,两次使用B装置,其中所盛的药品的化学式依次为CuO、
②检查装置的气密性后,加热装置B前必须进行的操作是
(2)若装置A的锥形瓶中装Na2O2,分液漏斗中装浓氨水,装置B中装红热的铂网可以进行氨的催化氧化;
①装置A的锥形瓶中反应的化学方程式为:
若气流按从左到右连接顺序A→C→B→C的方向,则B中氨的催化氧化反应方程式为:
②装置B中除了观察到铂网保持红热外,还可能观察到的现象是:
(3)若装置A的锥形瓶中装Na2SO3固体,分液漏斗中装H2SO4溶液,装置B中装Na2O2固体,根据A→D→B→C的气流方向充分反应后可以探究足量的SO2气体与过氧化钠反应的固体产物成分.
①甲同学认为SO2与过氧化钠的反应为:2SO2+2Na2O2=2Na2SO3+O2
②乙同学认为SO2与过氧化钠的反应为:SO2+Na2O2=Na2SO4
请你设计简单的实验方案验证甲、乙的实验结论:

(1)若装置A的锥形瓶中装锌片,分液漏斗中装稀硫酸,则可验证H2的还原性并检验其氧化产物.
①若按顺序A→D→B→B→C连接仪器装置时,两次使用B装置,其中所盛的药品的化学式依次为CuO、
CuSO4
CuSO4
.②检查装置的气密性后,加热装置B前必须进行的操作是
通一会儿氢气后,检验氢气的纯度
通一会儿氢气后,检验氢气的纯度
.(2)若装置A的锥形瓶中装Na2O2,分液漏斗中装浓氨水,装置B中装红热的铂网可以进行氨的催化氧化;
①装置A的锥形瓶中反应的化学方程式为:
2Na2O2+2H2O═4NaOH+O2↑,NH3?H2O
NH3↑+H2O
| ||
2Na2O2+2H2O═4NaOH+O2↑,NH3?H2O
NH3↑+H2O
;
| ||
若气流按从左到右连接顺序A→C→B→C的方向,则B中氨的催化氧化反应方程式为:
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
②装置B中除了观察到铂网保持红热外,还可能观察到的现象是:
红棕色气体出现
红棕色气体出现
.(3)若装置A的锥形瓶中装Na2SO3固体,分液漏斗中装H2SO4溶液,装置B中装Na2O2固体,根据A→D→B→C的气流方向充分反应后可以探究足量的SO2气体与过氧化钠反应的固体产物成分.
①甲同学认为SO2与过氧化钠的反应为:2SO2+2Na2O2=2Na2SO3+O2
②乙同学认为SO2与过氧化钠的反应为:SO2+Na2O2=Na2SO4
请你设计简单的实验方案验证甲、乙的实验结论:
取少量固体产物于试管中溶于水,然后加BaCl2溶液会产生白色沉淀,继续加过量的稀盐酸,若沉淀全部溶解,则甲同学正确,若沉淀不溶解,则乙同学正确
取少量固体产物于试管中溶于水,然后加BaCl2溶液会产生白色沉淀,继续加过量的稀盐酸,若沉淀全部溶解,则甲同学正确,若沉淀不溶解,则乙同学正确
.分析:(1)①第二次使用B装置的作用是检验产物水;
②氢气容易发生爆炸;
(2)①在A中过氧化钠会与氨水中的水发生反应;氨气与氧气反应生成一氧化氮和水;
②一氧化氮易被氧气氧化为二氧化氮;
(3)硫酸钡不溶于稀盐酸,亚硫酸钡可溶于稀盐酸;
②氢气容易发生爆炸;
(2)①在A中过氧化钠会与氨水中的水发生反应;氨气与氧气反应生成一氧化氮和水;
②一氧化氮易被氧气氧化为二氧化氮;
(3)硫酸钡不溶于稀盐酸,亚硫酸钡可溶于稀盐酸;
解答:解:(1)①第二次使用B装置的作用是检验产物水,可用无水硫酸铜,故答案为:CuSO4;
②氢气容易发生爆炸,加热前应先检验氢气的纯度,故答案为:通一会儿氢气后,检验氢气的纯度;
(2)①在A中过氧化钠与水发生反应生成氧气,该反应放热,一水合氨发生分解,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,NH3?H2O
NH3↑+H2O;氨的催化氧化反应方程式:4NH3+5O2=4NO+6H2O;,
故答案为:2Na2O2+2H2O═4NaOH+O2↑,NH3?H2O
NH3↑+H2O;4NH3+5O2
4NO+6H2O;
②一氧化氮易被氧气氧化为红棕色的二氧化氮,故答案为:有红棕色气体出现;
(3)取少量固体产物于试管中溶于水,然后加BaCl2溶液会产生白色沉淀,继续加过量的稀盐酸,硫酸钡不溶于稀盐酸,亚硫酸钡可溶于稀盐酸,
故答案为:取少量固体产物于试管中溶于水,然后加BaCl2溶液会产生白色沉淀,继续加过量的稀盐酸,若沉淀全部溶解,则甲同学正确,若沉淀不溶解,则乙同学正确;
②氢气容易发生爆炸,加热前应先检验氢气的纯度,故答案为:通一会儿氢气后,检验氢气的纯度;
(2)①在A中过氧化钠与水发生反应生成氧气,该反应放热,一水合氨发生分解,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,NH3?H2O
| ||
故答案为:2Na2O2+2H2O═4NaOH+O2↑,NH3?H2O
| ||
| ||
| △ |
②一氧化氮易被氧气氧化为红棕色的二氧化氮,故答案为:有红棕色气体出现;
(3)取少量固体产物于试管中溶于水,然后加BaCl2溶液会产生白色沉淀,继续加过量的稀盐酸,硫酸钡不溶于稀盐酸,亚硫酸钡可溶于稀盐酸,
故答案为:取少量固体产物于试管中溶于水,然后加BaCl2溶液会产生白色沉淀,继续加过量的稀盐酸,若沉淀全部溶解,则甲同学正确,若沉淀不溶解,则乙同学正确;
点评:本题考查化学实验方案设计,难度较大,注意掌握实验的原理.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目