题目内容
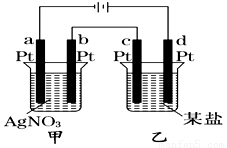
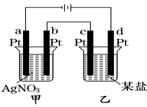
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.64 g某金属,下列说法正确的是

A.甲池b极上析出金属银,乙池c极上析出某金属
B.甲池a极上析出金属银,乙池d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
C
【解析】
试题分析:a、c为阴极,b、d为阳极,金属阳离子移向阴极发生还原反应析出金属单质,则甲池a极上析出金属银,乙池c极上析出某金属,故A和B均错误;Ag++e—=Ag,n(Ag)=2.16g÷108g•mol—1=0.02mol,根据系数之比等于物质的量之比,则转移电子也为0.02mol,而Mn++ne—=M,根据电子守恒,则n×0.64g÷M(M)=0.02mol,M(M)=32n g•mol—1,n=1时不成立,n=2时M为Cu,故C正确;阴极放电能力:Mg2+<H+,则某盐溶液不可能是Mg(NO3)2溶液,故D错误。
考点:考查电解原理,主要涉及电极、电极反应、金属阳离子的放电顺序的辨认以及电子守恒法的应用。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器。他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置。通电数分钟后,果真制得了消毒液。他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是....…………..( )
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极,b为阳极;HClO和NaCl |
某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器。他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置。通电数分钟后,果真制得了消毒液。他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是....…………..( )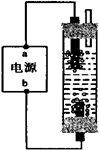
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极,b为阳极;HClO和NaCl |