题目内容
绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
(1)向其中滴入2~3滴的KSCN溶液,震荡,溶液变成红色。 (2分)
(2)①当最后一滴KMnO4溶液滴入锥形瓶后,瓶内溶液变成浅红色且半分钟内不褪色。
(2分)
②0.04000 mol/L (3分,计算结果1分,有效数字1分,单位1分)
(3)【反应原理】 12、3、6 H2O;4、8 (3分,物质1分,配平2分)
【操作与现象】少量(3滴)硫酸(2分); 溶液颜色很快变成黄色,并出现棕黄色浑浊(2分)
【分析与结论】作空白对照实验(1分);
用煤油隔绝空气,并加入少量的铁屑和稀硫酸(2分)
解析试题分析:(1)久置的绿矾溶液容易被空气氧化变质,实质是其中的亚铁离子容易被氧化为铁离子,所以检验是否变质的方法是检验样品中是否含有铁离子,可选用KSCN试剂,操作是向其中滴入2~3滴的KSCN溶液,震荡,溶液变成红色。
(2)①使用紫红色的酸性高锰酸钾溶液滴定亚铁离子,所以到达终点时的现象是,最后一滴KMnO4溶液滴入锥形瓶中溶液颜色变成浅红色,且在半分钟内不褪色。
②实验中分了3次进行滴定,但是第2组数据消耗KMnO4溶液体积24.98ml明显高于其它2组,所以该数据应该舍去,所以消耗KMnO4溶液平均体积=(20.02mL+19.98mL)/2=20.00ml,所以根据方程式比例可得亚铁离子的浓度c(Fe2+)=5n(MnO4—)/V(Fe2+)="5×0.01000mol/L×20.00ml/25.00ml=0.04000" mol/L。计算中要注意有效数字的保留。
(3)【反应原理】此处考察的是氧化还原反应的缺项配平,根据产物Fe(OH)3 中含有H,可以推测原反应物必有水参加,所以缺项处为H2O;再根据氧化还原的特点找出化合价变化的Fe和O,用得失电子守恒来进行配平,可得到方程式为12Fe2+ +3O2 +6 H2O = 4Fe(OH)3↓+ 8Fe3+ 。
【操作与现象】由图中所给的四个试管和添加试剂可以看出,这四组实验目的是在比较在不同条件下FeSO4溶液的保存效果。所以领会题目意图,要充分应用上一题的反应方程式12Fe2+ +3O2 +6 H2O = 4Fe(OH)3↓+ 8Fe3+来解题。试管①对硫酸亚铁溶液没有做任何处理,试管①自然会发生反应式中的现象,亚铁离子很快被氧化为棕黄色的铁离子,同时还会有Fe(OH)3 沉淀产生。鉴于试管①,试管②添加了一层煤油以使溶液隔绝氧气,此方法必然会减缓亚铁离子被氧化;试管③添加了铁粉,铁粉可以把铁离子还原为亚铁离子,起到防氧化的目的,氧化减慢;考虑到亚铁离子除了被氧化之外,还容易发生水解,所以试管④中应该添加几滴稀硫酸溶液。
【分析与结论】所以综上所述,试管①设计意图只是用于作空白对照实验,而保存FeSO4溶液最佳方案应该是综合②③④操作,用煤油隔绝空气,并加入少量的铁屑和稀硫酸。
考点:本题考查的是综合探究实验,涉及的主要是铁盐的内容,围绕铁这块知识作答。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
| 水解反应 | 平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ | 7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ | 3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ | 3.2 × 10-7 |
请回答:(1)稀硝酸和Cu反应的化学方程式为 。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案: 。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化。 |
①据实验现象写出发生反应的离子方程式: 。
②导致实验过程中溶液pH略有上升的可能原因是 。
③解释乙同学的实验现象 。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的: 。
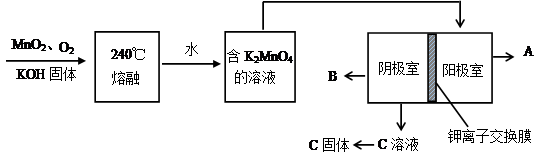
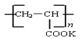 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。
 Ca2++
Ca2++