题目内容
(Ⅰ)已知反应:Na2SO3(固)+H2SO4(浓)
| ||
(Ⅱ)测定硫酸厂尾气中SO2含量(不考虑尾气中的SO3).
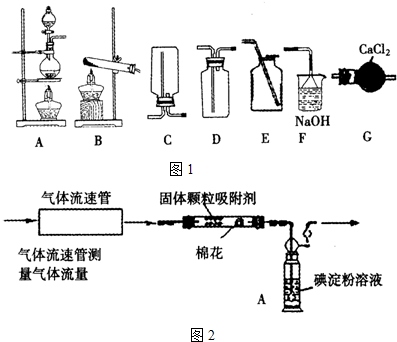
方案甲 化学学习小组设计了如图2装置来测定硫酸厂尾气中SO2含量. 通入气体,A中颜色变浅.当A中颜色变为无色时,停止通入气体.
(1)A中发生的离子反应方程式为:
(2)A中的试剂可用其它试剂替代,试写出一种可替代的试剂为
(3)当A中颜色变为无色时没有及时停止通气体,则测得的SO2含量
(4)若气体流速为a L/min,A中c(I2)=6mol/L,溶液体积为VL.2分钟时A中颜色变为无色. 则标准状况下SO2的体积百分含量为
方案乙 学习小组设计了如下方案:尾气
| H2O2(过量) |
| Ba(OH)2过量 |
某同学认为该方案无需使用H2O2,可直接将SO2通入过量的Ba(OH)2溶液中.你认为该同学是否正确并说明理由
Ⅱ、(1)二氧化硫通入淀粉碘化钾溶液中发生反应二氧化硫被碘单质氧化为硫酸;
(2)A中的试剂可用其它试剂替代需要能吸收二氧化硫且反应现象明显,能证明二氧化硫全部被吸收的试剂;
(3)反应管内溶液蓝色消失后,没有及时停止通气,与碘反应时二氧化硫过量,导致测定的剩余气体的体积偏大,导致测得的SO2的含量偏低;
(4)依据题干数据气体流速计算气体体积,结合碘单质全部反应消耗二氧化硫物质的量计算体积,得到二氧化硫的体积分数;二氧化硫通入氢氧化钡溶液生成的亚硫酸钡沉淀会被氧化为硫酸钡沉淀导致测定误差.
故答案为:ADF;
Ⅱ、(1)二氧化硫通入淀粉碘化钾溶液中发生反应二氧化硫被碘单质氧化为硫酸反应的离子方程式为I2+SO2+2H2O=H2SO4+2HI,
故答案为:I2+SO2+2H2O=H2SO4+2HI;
(2)A中的试剂可用其它试剂替代需要能吸收二氧化硫且反应现象明显,能证明二氧化硫全部被吸收的试剂,可以利用高锰酸钾溶液或溴水溶液代替,
故答案为:高锰酸钾溶液或溴水溶液;
(3)溶液蓝色刚好褪去,应及时停止通气,若反应管内溶液蓝色消失后,没有及时停止通气,与碘反应时二氧化硫过量,导致测定的剩余气体的体积偏大,测定的二氧化硫的体积偏小,导致测得的SO2的含量偏低,
故答案为:偏低;
(4)若气体流速为a L/min,A中c(I2)=bmol/L,溶液体积为VL.2分钟时A中颜色变为无色.气体通入体积=2aL,依据化学方程式I2+SO2+2H2O=H2SO4+2HI,计算得到二氧化硫物质的量=碘单质物质的量=bVmol,二氧化硫体积标准状况下=bVmol×22.4L/mol=22.4bVL,则标准状况下SO2的体积百分含量=
| 22.4bVL |
| 2aL |
| 11.2bV |
| a |
故答案为:
| 11.2bV |
| a |

 阅读快车系列答案
阅读快车系列答案随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3=-867kJ·mol-1
则△H2= 。
Ⅱ. 化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1) 将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为
C(s) + H2O(g) == CO(g) + H2(g)
该反应的化学平衡常数表达式为K= 。
800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
a加入催化剂 b降低温度 c缩小容器体积 d减少CO2的量
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
 |
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是 。
Ⅲ.开发新能源是解决大气污染的有效途径之一。直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:

通入a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。




 CO2(g)
+ H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将
移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g)
+ H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将
移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如图t2后所示的变化,则改变的条件可能是 (填符号)。

