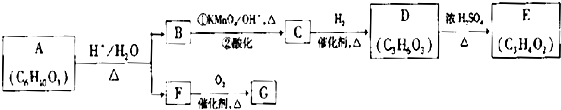
题目内容
【化学--选修2:化学与技术】自来水生产的流程示意图见下:
(1)混凝剂除去悬浮物质的过程______(填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4?7H2O是常用的混凝剂,它在水中最终生成______沉淀.
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加______后加______,原因是______.
(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).
Cl2+H2O?HCl+HClO K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:______.下列物质中,______可以作为氯气的代用品(填写序号).
①臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子.用离子交换树脂软化硬水时,先后把水通过分别装有______离子交换树脂和______离子交换树脂的离子交换柱(填“阴”或“阳”,阳离子交换树脂为HR型,阴离子交换树脂为R′OH型).
(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应.打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成.用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液.已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+.上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2 MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
则水中的溶解氧量为______mg?L-1.
【答案】分析:(1)常用混凝剂为FeSO4?7H2O,结合FeSO4?7H2O的性质分析;
(2)除去Ca2+、Mg2+,应先加入石灰,然后加入纯碱,可除去过量的钙离子;
(3)根据氯气与水反应的平衡常数和平衡移动原理分析;臭氧和K2FeO4具有强氧化性,可用作饮用水的消毒剂;
(4)OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用;
(5)可利用关系式发生计算.
解答:解:(1)常用混凝剂为FeSO4?7H2O,被氧化、水解后生成Fe(OH)3,具有吸附作用,可除去水中的悬浮物,故答案为:③;Fe(OH)3;
(2)除去Ca2+、Mg2+,应先加入石灰,然后加入纯碱,过量的钙离子可通过纯碱使之沉淀下来,
故答案为:石灰;纯碱;过量的钙离子可通过纯碱使之沉淀下来;
(3)氯气和水反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO,可有效控制次氯酸的浓度,臭氧和K2FeO4具有强氧化性,可用作饮用水的消毒剂,
故答案为:由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO;①③;
(4)通过阴离子交换树脂后生成OH-,OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用,故先通过阳离子交换树脂再通过阴离子交换树脂,故答案为:阳; 阴;
(5)已知:2Mn2++4OH-+O2=2MnO(OH)2; MnO(OH)2+2I-+4H+=I2+Mn2++3H2O;I2+2S2O32-=2I-+S4O62-,
可得关系式:O2~4S2O32-,n(S2O32-)=0.01mol/L×0.006L=6×10-5mol,则n(O2)= ×6×10-5mol=1.5×10-5mol,
×6×10-5mol=1.5×10-5mol,
m(O2)=1.5×10-5mol×32g/mol=48×10-5g=0.48mg,
则水中的溶解氧量为为 =12.0mg?L-1,
=12.0mg?L-1,
故答案为:12.0.
点评:本题考查物质的含量测定以及物质的分离、提纯实验方案的设计,题目难度中等,注意硬水的软化原理,把握关系式法的运用.
(2)除去Ca2+、Mg2+,应先加入石灰,然后加入纯碱,可除去过量的钙离子;
(3)根据氯气与水反应的平衡常数和平衡移动原理分析;臭氧和K2FeO4具有强氧化性,可用作饮用水的消毒剂;
(4)OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用;
(5)可利用关系式发生计算.
解答:解:(1)常用混凝剂为FeSO4?7H2O,被氧化、水解后生成Fe(OH)3,具有吸附作用,可除去水中的悬浮物,故答案为:③;Fe(OH)3;
(2)除去Ca2+、Mg2+,应先加入石灰,然后加入纯碱,过量的钙离子可通过纯碱使之沉淀下来,
故答案为:石灰;纯碱;过量的钙离子可通过纯碱使之沉淀下来;
(3)氯气和水反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO,可有效控制次氯酸的浓度,臭氧和K2FeO4具有强氧化性,可用作饮用水的消毒剂,
故答案为:由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO;①③;
(4)通过阴离子交换树脂后生成OH-,OH-会与钙、镁离子反应生成沉淀,影响阳离子交换树脂发挥作用,故先通过阳离子交换树脂再通过阴离子交换树脂,故答案为:阳; 阴;
(5)已知:2Mn2++4OH-+O2=2MnO(OH)2; MnO(OH)2+2I-+4H+=I2+Mn2++3H2O;I2+2S2O32-=2I-+S4O62-,
可得关系式:O2~4S2O32-,n(S2O32-)=0.01mol/L×0.006L=6×10-5mol,则n(O2)=
 ×6×10-5mol=1.5×10-5mol,
×6×10-5mol=1.5×10-5mol,m(O2)=1.5×10-5mol×32g/mol=48×10-5g=0.48mg,
则水中的溶解氧量为为
 =12.0mg?L-1,
=12.0mg?L-1,故答案为:12.0.
点评:本题考查物质的含量测定以及物质的分离、提纯实验方案的设计,题目难度中等,注意硬水的软化原理,把握关系式法的运用.

练习册系列答案
相关题目
【化学--选修:物质结构与性质】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式: .
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 .
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 .
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 ,其中心离子是 ,配位数为 .
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是 和 .
②T元素最可能是 区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 ,其中心原子的杂化方式为 .
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是
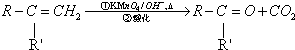 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团)