题目内容
根据题意,完成下列问题.(1)常温下,将1mL pH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液pH=______.
(2)某温度时,测得0.01mol?L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=______.该温度______25℃(填“高于”、“低于”或“等于”).
(3)常温下,设pH=5的H2SO4的溶液中由水电离出的H+浓度为c1;pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2,则
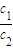 =______.
=______.(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计).
若所得混合溶液呈中性,则a:b=______.
若所得混合溶液pH=12,则a:b=______.
【答案】分析:(1)1mL pH=1的H2SO4溶液加水稀释到100mL,c(H+)由0.1mol/L变为0.001mol/L;
(2)常温下,0.01mol?L-1的NaOH溶液的pH为12,而某温度时测得0.01mol?L-1的NaOH溶液的pH为11,则KW增大;
(3)pH=5的H2SO4的溶液中由水电离出的H+浓度为c1=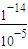 =10-9mol/L,pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2=10-9mol/L;
=10-9mol/L,pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2=10-9mol/L;
(4)若所得混合溶液呈中性,aL×0.1mol/L=bL×0.001mol/L;若所得混合溶液pH=12,则碱过量,所以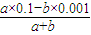 =0.01mol/L.
=0.01mol/L.
解答:解:(1)1mL pH=1的H2SO4溶液加水稀释到100mL,c(H+)由0.1mol/L变为0.001mol/L,则pH=-lg0.001=3,
故答案为:3;
(2)常温下,0.01mol?L-1的NaOH溶液的pH为12,而某温度时测得0.01mol?L-1的NaOH溶液的pH为11,则KW=0.01×10-11=1.0×10-13,温度高于25℃,
故答案为:1.0×10-13;
(3)pH=5的H2SO4的溶液中由水电离出的H+浓度为c1=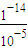 =10-9mol/L,pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2=10-9mol/L,则
=10-9mol/L,pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2=10-9mol/L,则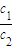 =1,故答案为:1;
=1,故答案为:1;
(4)若所得混合溶液呈中性,aL×0.1mol/L=bL×0.001mol/L,解得a:b=1:100;若所得混合溶液pH=12,则碱过量,所以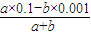 =0.01mol/L,解得a:b=11:90,
=0.01mol/L,解得a:b=11:90,
故答案为:1:100;11:90.
点评:本题考查酸碱混合pH的计算,明确浓度与pH的换算、酸碱混合溶液为中性、碱性时离子浓度的关系等是解答本题的关键,题目难度中等.
(2)常温下,0.01mol?L-1的NaOH溶液的pH为12,而某温度时测得0.01mol?L-1的NaOH溶液的pH为11,则KW增大;
(3)pH=5的H2SO4的溶液中由水电离出的H+浓度为c1=
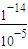 =10-9mol/L,pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2=10-9mol/L;
=10-9mol/L,pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2=10-9mol/L;(4)若所得混合溶液呈中性,aL×0.1mol/L=bL×0.001mol/L;若所得混合溶液pH=12,则碱过量,所以
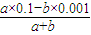 =0.01mol/L.
=0.01mol/L.解答:解:(1)1mL pH=1的H2SO4溶液加水稀释到100mL,c(H+)由0.1mol/L变为0.001mol/L,则pH=-lg0.001=3,
故答案为:3;
(2)常温下,0.01mol?L-1的NaOH溶液的pH为12,而某温度时测得0.01mol?L-1的NaOH溶液的pH为11,则KW=0.01×10-11=1.0×10-13,温度高于25℃,
故答案为:1.0×10-13;
(3)pH=5的H2SO4的溶液中由水电离出的H+浓度为c1=
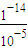 =10-9mol/L,pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2=10-9mol/L,则
=10-9mol/L,pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2=10-9mol/L,则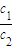 =1,故答案为:1;
=1,故答案为:1;(4)若所得混合溶液呈中性,aL×0.1mol/L=bL×0.001mol/L,解得a:b=1:100;若所得混合溶液pH=12,则碱过量,所以
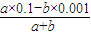 =0.01mol/L,解得a:b=11:90,
=0.01mol/L,解得a:b=11:90,故答案为:1:100;11:90.
点评:本题考查酸碱混合pH的计算,明确浓度与pH的换算、酸碱混合溶液为中性、碱性时离子浓度的关系等是解答本题的关键,题目难度中等.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目

