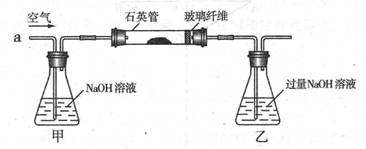
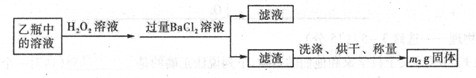
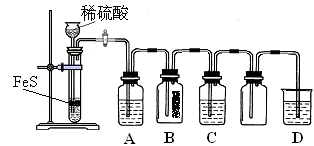
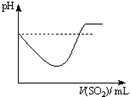
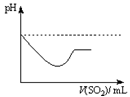
题目内容
下列对事实的解释不正确的是
| 选项 | 事实 | 解释 |
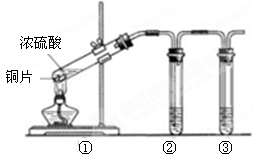
| A | 用铝罐槽车储运浓硫酸 | 浓硫酸的强氧化性使铝钝化 |
| B | 用饱和NH4Cl溶液处理过的舞台布帘可防火 | NH4Cl分解吸热,且分解产物能隔绝空气中的氧气 |
| C | 钠元素的焰色反应呈黄色 | Na2O2是一种淡黄色的固体 |
| D | SO2能使溴水褪色 | SO2具有还原性 |
C
试题分析:浓硫酸具有强氧化性,常温下使铝钝化,铝表面产生一层致密的氧化膜,因此可用铝罐车储运浓硫酸,故A正确;由氯化铵受热分解,生成氨气合氯化氢,该反应是吸热反应,且氨气合氯化氢气体能隔绝空气,所以用饱和氯化铵溶液处理过的舞台布帘可防火,故B正确;钠元素的焰色反应呈黄色,这是钠元素的物理性质,与过氧化钠的性质无因果关系,故C错误;SO2能使溴水褪色,因为SO2+Br2+2H2O=H2SO4+2HBr,该反应中硫元素由+4升为+6价,则二氧化硫失去电子,发生氧化反应,所以二氧化硫是还原剂,具有还原性,故D正确。

练习册系列答案
相关题目
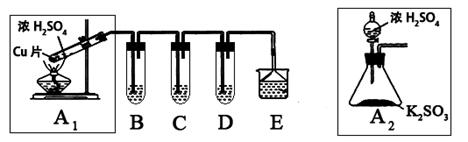
 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2