题目内容
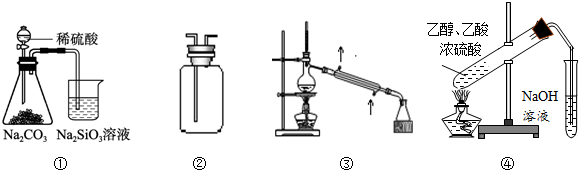
关于Cl2的实验室制法,下列说法中错误的是( )
| A、原料是浓盐酸和MnO2 | B、可以用排饱和食盐水法收集氯气 | C、该反应需要加热 | D、用NaOH溶液除去Cl2中混有的HCl |
分析:A.实验室制Cl2用浓盐酸和MnO2反应,MnO2是氧化剂,氯化氢为还原剂;
B.食盐水溶液中的氯离子抑制氯气的溶解,可以用排饱和食盐水法收集氯气;
C.根据实验室制Cl2实验原理进行解答;
D.氯气和氢氧化钠反应,所以不可用氢氧化钠除去Cl2中混有的HCl;
B.食盐水溶液中的氯离子抑制氯气的溶解,可以用排饱和食盐水法收集氯气;
C.根据实验室制Cl2实验原理进行解答;
D.氯气和氢氧化钠反应,所以不可用氢氧化钠除去Cl2中混有的HCl;
解答:解:A.实验室制Cl2的反应为4HCl(浓)十MnO2
MnCl2+Cl2↑+2H2O,故A正确;
B.氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体,故B正确;
C.实验室制Cl2用浓盐酸和MnO2反应,反应需加热,故C正确;
D.氯气能和氢氧化钠反应生成氯化钠、次氯酸钠、水方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,所以不可用氢氧化钠除去Cl2中混有的HCl,故D错误;
故选D.
| ||
B.氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体,故B正确;
C.实验室制Cl2用浓盐酸和MnO2反应,反应需加热,故C正确;
D.氯气能和氢氧化钠反应生成氯化钠、次氯酸钠、水方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,所以不可用氢氧化钠除去Cl2中混有的HCl,故D错误;
故选D.
点评:本题主要考查了实验室制氯气,掌握制取氯气的反应原理、除杂方法是解答的关键,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目