��Ŀ����
һ�������������Ժ�CO2������Ӧ��
Fe(s)+CO2(g)FeO(s)+CO(g)����H>0
��1��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ����8������CO��ƽ����Ӧ����v(CO)= ��
��2�����д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� ������ţ���
A�������¶� B������ѹǿ C������һ�������� D���ټ���һЩ����
��3����Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2����CO2��ת���ʽ� �����������С���������䡱�����÷�Ӧ��ƽ�ⳣ��K= ���¶����ߣ�K �����������С���������䡱����
��4��������Ҫ������������������Ӧ��ʮ�ֹ㷺����������(Na2FeO4)��һ����������ˮ������������������������֮һ�ǣ�ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������÷�Ӧ�����ӷ���ʽΪ ��
��5����֪��2CO(g)+O2(g)==2CO2(g)��H=��566 kJ/mol��2H2(g)+O2(g)==2H2O(g)��H=��483.6 kJ/mol��д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ ��
��6����֪Ksp(Fe(OH)3)= 8´10-38��ij��Һ�к���Fe3��Ũ����0.05mol��L-1�����ҪʹFe(OH)3������ȫpH����Ϊ ����Һ������Ũ��С��1��10-5mol/Lʱ��������ȫ��lg2=0.3��
��1��0.075mol��L-1��min-1��2�֣� ��2��A ��2�֣� ��3������ ��2�֣�
��4��2Fe(OH)3+3ClO��+4OH��==2FeO42��+3Cl��+5H2O ��3�֣�
(5) CO(g) + H2O(g)==CO2(g)+ H2(g) ��H=��41.2 kJ/mol (3��)
(6 )3.3��3�֣�
����:��

 ��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��
��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0 ��2011?����ģ�⣩һ�������������Ժ�CO2������Ӧ��
��2011?����ģ�⣩һ�������������Ժ�CO2������Ӧ�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0 ��2012?��������ģ������һ����Ҫ�Ľ��������ĵ��ʼ����������Ÿ��Ե����ʣ�һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g������֪�÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
��2012?��������ģ������һ����Ҫ�Ľ��������ĵ��ʼ����������Ÿ��Ե����ʣ�һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g������֪�÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��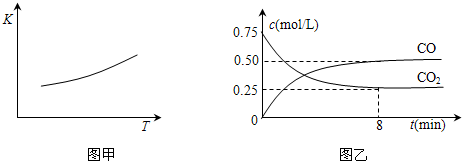
 FeO(s)+CO(g)����H>0
FeO(s)+CO(g)����H>0