题目内容
A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。试回答下列问题:(1)A、B的元素符号分别为______________、______________。
(2)写出Y水解的离子方程式______________。
(3)将
(4)在101 kPa时,
(1)H C
(2)![]() +H2O
+H2O![]() NH3·H2O+H+
NH3·H2O+H+
(3)c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
(4)4NH3(g)+3O2(g)====2N2(g)+6H2O(l);ΔH=-1 264.8 kJ/mol
解析:B的最外层电子数是其次外层电子数的2倍,可知B为碳。原子序数比B(碳)小的A和原子序数比B(碳)大的C能形成气态分子X或一种+1价阳离子,对短周期元素试探排查,可知A为氢,C为氮,X为NH3,+1价阳离子为![]() 。与C(氮)相邻且单质为无色气体的D只能是氧。(3)问,n(C)=
。与C(氮)相邻且单质为无色气体的D只能是氧。(3)问,n(C)=![]() =0.75 mol,n(NaOH)=
=0.75 mol,n(NaOH)=![]() 、
、![]() 均少量水解,溶液显碱性,故有c(Na+)>c(
均少量水解,溶液显碱性,故有c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)。(4)问,NH3和O2反应生成的液态化合物为H2O,另一对环境无污染的稳定物质应是N2,又因4 mol NH3反应放出的热量为18.6 kJ×
)>c(OH-)>c(H+)。(4)问,NH3和O2反应生成的液态化合物为H2O,另一对环境无污染的稳定物质应是N2,又因4 mol NH3反应放出的热量为18.6 kJ×![]() =1 264.8 kJ,故反应的热化学方程式为4NH3(g)+3O2(g)====2N2(g)+6H2O(l);ΔH=-1 264.8 kJ·mol-1。
=1 264.8 kJ,故反应的热化学方程式为4NH3(g)+3O2(g)====2N2(g)+6H2O(l);ΔH=-1 264.8 kJ·mol-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |

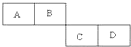 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.