题目内容
1.虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功.直到1986年,化学家Karl Christe首次用化学方法制得了F2.他提出的三步反应如下(反应①、②里氟元素化合价不变):①KMnO4+KF+H2O2+HF→K2MnF6+O2+H2O
②SbCl5+HF→SbF5+5HCl
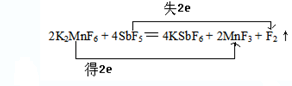
③2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为O2,为什么填这一物质,试用氧化还原反应理论解释KMnO4中Mn化合降低,则H2O2必作还原剂.
(2)反应③中的氧化剂为K2MnF6,被氧化的元素为氟元素.
(3)标出反应③中电子转移的方向和数目.(将答案写在下面空格上)
 .
.
分析 (1)双氧水能被高锰酸钾氧化为氧气单质;
(2)化合价升高元素失去电子,被氧化,所在反应物是还原剂,对应产物是氧化产物;化合价降低元素得到电子,被还原,所在的反应物是氧化剂,对应产物是还原产物;
(3)氧化还原反应中,化合价升高元素失去电子,化合价降低元素得到电子,得失电子数相等即为反应转移电子数.
解答 解:(1)化合价降低元素所在的反应物是氧化剂,KMnO4中Mn化合降低,所以是氧化剂,双氧水能被高锰酸钾氧化为氧气单质,故答案为:O2;KMnO4中Mn化合降低,则H2O2必作还原剂;
(2)反应2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑中,K2MnF6中Mn元素的化合价降低,所以K2MnF6是氧化剂,SbF5中F元素化合价升高,被氧化,所以SbF5是还原剂,故答案为:K2MnF6;氟元素;
(3)该氧化还原反应中,化合价升高的氟元素共失去2mol电子,化合价降低的锰元素共得到2mol电子,得失电子数相等,即反应转移电子数为2,电子转移的方向和数目如下所示 ,故答案为:
,故答案为: .
.
点评 本题考查学生氧化还原反应中的基本概念和电子转移知识,综合性较强,难度较大.

练习册系列答案
相关题目
11.下面不能由单质直接化合而得到的化合物是( )
| A. | FeS | B. | Al2S3 | C. | FeCl2 | D. | Fe3O4 |
12.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖.关于NO的下列叙述正确的是( )
| A. | NO可以由Cu和稀硝酸反应制得? | |
| B. | NO不会造成空气污染,是一种无害气体 | |
| C. | NO可以由N2在O2中燃烧制得? | |
| D. | NO是红棕色气体 |
9.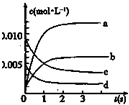 在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:
在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{c(XY{\;}_{2}){\;}^{2}}{c(XY){\;}^{2}c(Y{\;}_{2})}$.
(2)如图中表示XY2的变化的曲线是b.用Y2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•S-1.
(3)能说明该反应已达到平衡状态的是B.
A.v(XY2)=2v(Y2)
B.容器内压强保持不变
C.XY、Y2、XY2的浓度之比为2:1:2
D.容器内密度保持不变.
 在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:
在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(XY)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示XY2的变化的曲线是b.用Y2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•S-1.
(3)能说明该反应已达到平衡状态的是B.
A.v(XY2)=2v(Y2)
B.容器内压强保持不变
C.XY、Y2、XY2的浓度之比为2:1:2
D.容器内密度保持不变.
16.已知标况下,33.6L CO2含有a个分子,其质量为b g,则阿伏伽德罗常数可表示为( )
| A. | $\frac{2a}{3}$ | B. | $\frac{44a}{b}$ | C. | $\frac{b}{112a}$ | D. | $\frac{a}{56b}$ |
6.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
| A. | 1:1 | B. | 2:3 | C. | 1:4 | D. | 1:3 |
13.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
①不溶于水 ②易溶于水 ③比水更容易使碘溶解 ④必须比水密度大
⑤不与碘发生化学反应 ⑥易与碘发生化学反应.
①不溶于水 ②易溶于水 ③比水更容易使碘溶解 ④必须比水密度大
⑤不与碘发生化学反应 ⑥易与碘发生化学反应.
| A. | ①⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④⑤ |
10.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,16g O2和O3混合物中所含原子数为NA | |
| B. | 标准状况下,等体积 Cl2和CCl4中所含氯原子数为1﹕2 | |
| C. | 常温常压下,14g N2含有电子数为7NA | |
| D. | 28g CO与22.4L CO2所含的碳原子数均为NA |
16.以下物质间的每步转化通过一步反应不能实现的是( )
| A. | Na→Na2O→NaOH→Na2CO3 | B. | Al→Al2O3→Al2(SO4)3→Al(OH)3 | ||
| C. | S→SO3→H2SO4→SO2 | D. | N2→NO→NO2→HNO3 |