题目内容
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | (1) | (2) | ||||||
| 3 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 4 | (10) | (11) | (12) |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的酸是
(3)在(3)与(4)中,化学性质较活泼的是
(4)在(8)和(12)中,化学性质较活泼的是
(5)其中(1)(2)(3)(4)四种元素形成的离子半径由大到小的关系为:
(1)同主族自上而下金属性增强,同周期自左而右金属性减弱,故金属性最强的元素在周期表的右下角;
最不活泼的元素为零族元素;
(2)氟元素没有含氧酸,故HClO4是最强的无机含氧酸;氢氧化铝是两性氢氧化物;
(3)同周期自左而右金属性减弱,可以利用与水反应的剧烈程度判断;
(4)同主族自上而下非金属性减弱,可以利用氯气与溴化钠置换得到溴单质证明;
(5)电子层结构相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多离子半径越大.
(1)同主族自上而下金属性增强,同周期自左而右金属性减弱,故金属性最强的元素在周期表的右下角,最活泼的金属为K,最不活泼的元素为零族元素Ar,
故答案为:K;Ar;
(2)氟元素没有含氧酸,故HClO4是最强的无机含氧酸,氢氧化铝是两性氢氧化物,故答案为:高氯酸;氢氧化铝;
(3)同周期自左而右金属性减弱,故Na的化学性质活泼,Na与冷水剧烈反应,Mg与沸水沸水缓慢反应,可以证明Na更活泼,
故答案为:Na;Na与冷水剧烈反应,Mg与沸水沸水缓慢反应;
(4)同主族自上而下非金属性减弱,故Cl的化学性质更活泼,氯气通入NaBr溶液后,溶液呈橙色,发生反应Cl2+2NaBr=2NaCl+Br2,说明氯气更活泼,
故答案为:Cl;氯气通入NaBr溶液后,溶液呈橙色,发生反应Cl2+2NaBr=2NaCl+Br2;
(5)N3-、F-、Na+、Mg2+电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->F->Na+>Mg2+,
S2-、Cl-电子层结构相同,Mg2+、Al3+电子层结构相同,电子层层结构相同,核电荷数越大离子半径越小,阴离子电子层较多,故离子半径S2->Cl->Mg2+>Al3+,
故答案为:N3->F->Na+>Mg2+;S2->Cl->Mg2+>Al3+.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案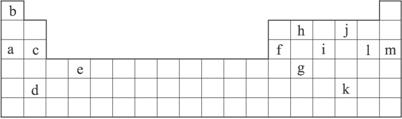
(1)下列_______________ (填写编号)组成元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、i ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7 296 | 4 570 | 1 820 |
失去第三个电子 | 11 799 | 6 920 | 2 750 |
失去第四个电子 |
| 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子所需的能量远远大于失去第一个电子所需的能量。
_____________________________________________________________________。
②表中X可能为以上13种元素中的_______________ (填写字母)元素。用元素符号表示X和j形成化合物的化学式:_______________。
③Y是周期表中_______________族元素。
④以上13种元素中,__________(填写字母)元素原子失去核外第一个电子需要的能量最多。
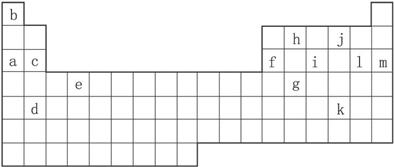
(1)下列_________填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
a.原子核对核外电子的吸引力
b.形成稳定结构的倾向下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7 296 | 4 570 | 1 820 |
失去第三个电子 | 11 799 | 6 920 | 2 750 |
失去第四个电子 |
| 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。________________________________。
②表中X可能为以上13种元素中的___________ (填写字母)元素。用元素符号表示X和j形成化合物的化学式____________________________________________ 。
③Y是周期表中___________族元素。
④以上13种元素中___________ (填写字母)元素原子失去核外第一个电子需要的能量最多。
(12分)下列是元素周期表的前三周期中的部分元素:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | H |
| He | |||||
| 二 | Li |
|
| C | N | O | F |
|
| 三 | Na | Mg |
|
|
| S | Cl |
|
(1)这些元素中,最活泼的元素是 ,最不活泼的元素是 ;
(2)原子结构示意图所表示的原子是 。其单质最硬的元素为 。
(3)Na和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为NaOH Mg(OH)2 (填“大于”或“小于”);
(4)请写出由上表第三周期元素形成的一种离子化合物的化学式 。
(12分)下列是元素周期表的前三周期中的部分元素:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
一 |
H |
|
He |
|||||
|
二 |
Li |
|
|
C |
N |
O |
F |
|
|
三 |
Na |
Mg |
|
|
|
S |
Cl |
|
(1)这些元素中,最活泼的元素是 ,最不活泼的元素是 ;
(2)原子结构示意图 所表示的原子是
。其单质最硬的元素为
。
所表示的原子是
。其单质最硬的元素为
。
(3)Na和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为NaOH Mg(OH)2 (填“大于”或“小于”);
(4)请写出由上表第三周期元素形成的一种离子化合物的化学式 。

 所表示的原子是 。其单质最硬的元素为 。
所表示的原子是 。其单质最硬的元素为 。