题目内容
将5.6 g Fe投入浓硝酸溶液中,产生红棕色气体A,把所得溶液蒸干,得到20g Fe(NO3)2和Fe(NO3)3的混合物,将该混合物在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入水中,剩余气体的体积为:.
A.1120 mL B.2240 mL C.360 mL D.4480 mL
B
解析试题分析:利用整体思维抓住反应的始终态,根据题意反应物可看作Fe、HNO3和水,最终生成物是Fe2O3和剩余气体NO(剩余气体不可能是O2,违背电子得失守恒),在该过程中铁元素化合价由0价升高到+3价,氮元素的化合价由+5价降为+2价,根据电子守恒可得n(NO)=n(Fe),代入数据计算可得。
考点:考查化学计算和整体思维、守恒思想的应用。

 阅读快车系列答案
阅读快车系列答案3月22日是 “世界水日”。下列各反应中,水作为还原剂的是
A.2H2+O2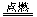 2H2O 2H2O | B.SO3+H2O=H2SO4 |
| C.2F2+2H2O=4HF+O2 | D.2Na+2H2O=2NaOH+H2↑ |
在8NH3+3Cl2=N2+6NH4Cl反应中,在该反应中氧化剂和还原剂的分子个数之比是( )。
| A.3:1 | B.3:8 | C.3:2 | D.8:3 |
发射“嫦娥二号”的长征火箭由三个子级构成。其中一子级上部装有液体四氧化二氮(N2O4),下部装有液体偏二甲肼(C2H8N2)高能燃料。发动机内燃烧的化学方程式为:C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑,该反应中
| A.C2H8N2发生还原反应 | B.C2H8N2是氧化剂 |
| C.N2O4发生氧化反应 | D.N2O4是氧化剂 |
根据表中信息,判断下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | | Cl- |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
为使Fe2+,Fe3+,Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH7.7、 pH4.5、pH6.6。某硫酸锌酸性溶液中含有少量Fe2+,Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是
| A.H2O2,ZnO | B.氨水 | C.KMnO4,ZnCO3 | D.NaOH溶液 |
工业废气中氮氧化物是造成污染的主要来源之一.为了防治污染,工业上常通入氨气与氮氧化物反应:NOx+NH3→N2+H2O.现有NO、NO2的混合气体3L,可用同温同压下的NH3 3.5L恰好与它完全反应生成N2。则原混合气体中NO和NO2的物质的量之比为( )
| A.1∶1 | B.1∶3 | C.2∶1 | D.1∶4 |
今有下列三个氧化还原反应:①2FeCl3+2KI 2KCl+2FeCl2+I2
2KCl+2FeCl2+I2
②2Fe+3Cl2 2FeCl3 ③2KMnO4+16HCl
2FeCl3 ③2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O,若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是
2KCl+2MnCl2+5Cl2↑+8H2O,若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是
| A.KMnO4 | B.FeCl3 | C.Cl2 | D.HCl |
制取新型水处理剂ClO2的化学方程式为( )
2KClO3+H2C2O4+H2SO4 2ClO2+K2SO4+2CO2+2H2O。下列说法不正确的是
2ClO2+K2SO4+2CO2+2H2O。下列说法不正确的是
| A.KClO3在反应中得到电子 | B.ClO2是还原产物 |
| C.H2C2O4 在反应中被氧化 | D.1mol KClO3参加反应有2mol电子转移 |