题目内容
下列叙述中正确的是( )
A.pH相同的CH3COONa溶液.C6H5ONa溶液.Na2CO3溶液.NaOH溶液:
c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH )
B.在常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH = 10
C.将pH = 3的一元弱酸HA和pH = 11的NaOH溶液充分混合后一定有:
c(OH-)<c(H+)<c(Na+)<c(A-)
D.将0.2 mol·L-1的盐酸与0.1 mol·L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-)
A
解析:
相同浓度的强碱弱酸盐溶液,水解能力越强的盐,溶液的pH越大,故当pH相同时,对应盐浓度越小;因水解能力CH3COO-<C6H5O-<CO32-,A对;B项中混合后,
c(OH-)=![]() mol/L,pH=12,B错;因两种溶液体积没有确定,故无法确定溶液中离子浓度关系,C错;由HCl+NaAlO2+H2O=NaCl+Al(OH)3↓+NaCl、Al(OH)3+HCL=
mol/L,pH=12,B错;因两种溶液体积没有确定,故无法确定溶液中离子浓度关系,C错;由HCl+NaAlO2+H2O=NaCl+Al(OH)3↓+NaCl、Al(OH)3+HCL=
AlCl3+3H2O及数量关系知,来源于酸的H+全部反应完,c(Al3+)>c(H+),D错。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
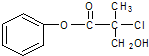 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


