题目内容
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素的原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物ACD3与其氢化物CA3反应生成一种盐X,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。
请回答下列问题:
(1)由A、B、D、E四种元素组成的某无机化合物Y受热易分解。写出少量Y溶液与足量Ba(OH)2溶液反应的离子方程式 。
(2)将铝片和镁片用导线连接,插入由A、D、E三种元素组成的稀溶液中构成原电池,则负极的电极反应式为 。
(3)常温下,ACD3的稀溶液与CA3的水溶液混合,可能出现的结果是 。
①pH<7,c(H+)>c(CD![]() )> c(OH-)> c(CA
)> c(OH-)> c(CA![]() )
)
②pH<7,c(CD![]() ) >c(OH-)=c(H+)> c(CA
) >c(OH-)=c(H+)> c(CA![]() )
)
③①pH>7,c(CA![]() )> c(OH-) >c(CD
)> c(OH-) >c(CD![]() )>c(H+)
)>c(H+)
④①pH<=7,c(CA![]() )>c(CD
)>c(CD![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
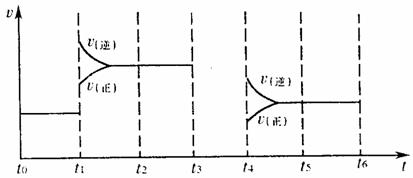
(4)对可逆反应3A2(g)+C2(g) ![]() 2CA3(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。
2CA3(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。
(5)温度为T℃时,将4amolA2和2amolC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则该反应的平衡常数为 。
(1)Ba2++HCO3―+OH―==BaCO3↓+H2O
(2)Al+4OH―→[Al(OH)4]―+3e―(其他合理写法也得分)
(3)③
(4)t0~t1
(5)4/a2(mol?L―1)―2

 名校课堂系列答案
名校课堂系列答案





 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )