题目内容
化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下方法来制备这种材料并测定这种材料的组成:
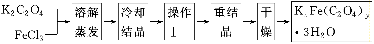
(1)结晶时应将溶液用冰水冷却置于在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________________。
(2)操作Ⅰ的名称是______________________。
(3)称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.100 0 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00 mL时恰好完全反应,H2C2O4与酸性KMnO4溶液反应的化学方程式是:__________________________。再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定。当Fe2+完全氧化时,用去KMnO4溶液4.00 mL,此滴定反应的离子方程式是____________。
(4)配制100 mL 0.100 0 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________(填仪器名称)。滴定终点时溶液颜色为________色,且30秒内不变色。
(5)经计算,化合物KxFe(C2O4)y·3H2O中,x=________。
(1)用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解
(2)过滤、洗涤
(3)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O MnO+5Fe2++8H+=Mn2++5Fe3++4H2O
(4)100 mL容量瓶、酸式滴定管 (紫)红
(5)3
【解析】(1)用冰水冷却,可使溶液的温度下降,降低了晶体的溶解度,便于更多晶体的析出;在暗处可防止晶体见光分解。
(2)操作Ⅰ是将晶体的溶液分离,故为过滤、洗涤。
(3)酸性KMnO4溶液氧化H2C2O4的化学方程式为为:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O;酸性KMnO4溶液氧化Fe2+的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。
(4)配制100 mL KMnO4溶液,需用100 moL容量瓶,滴定时操作时KMnO4溶液盛装于酸式滴定管中。
(5)n(C2O42-)=n(H2C2O4)=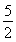 n(KMnO4)=
n(KMnO4)= ×0.1 mol/L×24×10-3 L=6×10-3 mol,
×0.1 mol/L×24×10-3 L=6×10-3 mol,
n(Fe3+)=5n(KMnO4)=5×0.1 mol/L×4×10-3 L=2×10-3 mol
n(Fe3+)∶n(C2O42-)=1∶y=2×10-3∶6×10-3=1∶3,y=3,由化合价代数和为零的原则可得:
x×(+1)+(+3)×1+(-2)×3=0
解得x=3,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案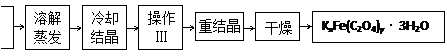 K2C2O4
K2C2O4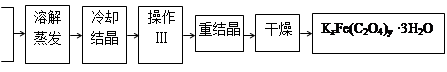 Ⅰ.制备
Ⅰ.制备 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。

 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
