题目内容
含苯酚的工业废水的处理流程如图所示。
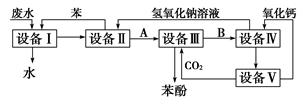
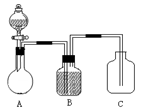
(1)①流程图设备Ⅰ中进行的是______操作(填写操作名称)。
②图中,能循环使用的物质是:C6H6、CO2______、______。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是_______________________________________________________。
(3)从废水中回收苯酚的方法是:①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③通入某物质又析出苯酚。试写出②、③两步的反应方程式:
_________________________________________________________________________________________。

(1)①流程图设备Ⅰ中进行的是______操作(填写操作名称)。
②图中,能循环使用的物质是:C6H6、CO2______、______。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是_______________________________________________________。
(3)从废水中回收苯酚的方法是:①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③通入某物质又析出苯酚。试写出②、③两步的反应方程式:
_________________________________________________________________________________________。
(1)①萃取(或萃取分液) (1分) ②NaOH溶液、(1分) CaO(1分)
(2)向污水中滴加FeCl3溶液,若溶液呈紫色,则表明污水中有苯酚(2分)
(3)
 (各2分)
(各2分)
(或者第二式C6H5ONa+CO2+H2O―→C6H5OH+NaHCO3))
(2)向污水中滴加FeCl3溶液,若溶液呈紫色,则表明污水中有苯酚(2分)
(3)
 (各2分)
(各2分)(或者第二式C6H5ONa+CO2+H2O―→C6H5OH+NaHCO3))
试题分析:(1)①从含苯酚的工业废水与苯进入设备Ⅰ得到无酚工业废水(此废水可以排放),说明在设备Ⅰ中进行的是萃取,利用苯与苯酚具有相似的结构,将苯酚从工业废水里抽提出来,用分液的方法将下层的工业废水放出排放,上层的苯酚苯溶液进入设备Ⅱ。
②根据流程图,盛有苯酚苯溶液的设备Ⅱ中注入氢氧化钠溶液,此时,具有酸性的苯酚跟氢氧化钠发生中和反应,生成苯酚钠和水,
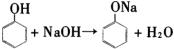 ,苯酚钠是离子化合物,易溶于水中。伴随上述化学反应的发生,在设备Ⅱ中的液体分为两层,上层是苯层,下层是苯酚钠的水溶液(即设问中的物质A),上层的苯通过管道送回设备Ⅰ中继续萃取工业废水中的苯酚,循环使用,下层的苯酚钠(A)溶液进入设备(Ⅲ)。根据流程图,下一步在盛有苯酚钠溶液的设备Ⅲ中,通入过量的二氧化碳气体,这两种物质间发生化学反应,生成苯酚和碳酸氢钠,
,苯酚钠是离子化合物,易溶于水中。伴随上述化学反应的发生,在设备Ⅱ中的液体分为两层,上层是苯层,下层是苯酚钠的水溶液(即设问中的物质A),上层的苯通过管道送回设备Ⅰ中继续萃取工业废水中的苯酚,循环使用,下层的苯酚钠(A)溶液进入设备(Ⅲ)。根据流程图,下一步在盛有苯酚钠溶液的设备Ⅲ中,通入过量的二氧化碳气体,这两种物质间发生化学反应,生成苯酚和碳酸氢钠, 的酸性比苯酚的酸性强,化学方程式如下:
的酸性比苯酚的酸性强,化学方程式如下: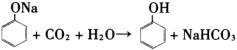 ,在析出的苯酚中含有微量水,呈油状液体,沉于设备Ⅲ液体的下层,经分液后再精馏可得苯酚。上层液体B是
,在析出的苯酚中含有微量水,呈油状液体,沉于设备Ⅲ液体的下层,经分液后再精馏可得苯酚。上层液体B是 溶液,经管道输送进入设备Ⅳ。盛有碳酸氢钠溶液的设备Ⅳ中,加入
溶液,经管道输送进入设备Ⅳ。盛有碳酸氢钠溶液的设备Ⅳ中,加入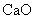 ,生石灰与碳酸氢钠溶液里的水化合变为熟石灰
,生石灰与碳酸氢钠溶液里的水化合变为熟石灰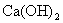 ,
,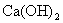 与
与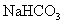 发生复分解反应,生成
发生复分解反应,生成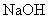 和
和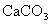 沉淀,化学方程式如下:
沉淀,化学方程式如下: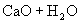

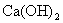 ,
,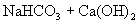

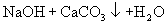 ,若把上述两个反应合并写为下式:
,若把上述两个反应合并写为下式: 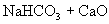

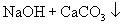 。
。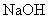 溶液与
溶液与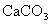 沉淀通过过滤分离。反应所得
沉淀通过过滤分离。反应所得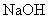 溶液,通过管道进入设备Ⅱ,循环使用;所得
溶液,通过管道进入设备Ⅱ,循环使用;所得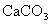 沉淀进入设备Ⅴ。在设备Ⅴ中的原料是
沉淀进入设备Ⅴ。在设备Ⅴ中的原料是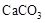 固体,所得的产品是氧化钙和二氧化碳,由此可知,设备Ⅴ应是石灰窑,其中,发生的化学反应为:
固体,所得的产品是氧化钙和二氧化碳,由此可知,设备Ⅴ应是石灰窑,其中,发生的化学反应为: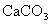

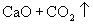 ,反应所得二氧化碳通入设备Ⅲ,反应所得氧化钙进入设备Ⅳ。
,反应所得二氧化碳通入设备Ⅲ,反应所得氧化钙进入设备Ⅳ。综上所述,在含苯酚工业废水提取苯酚的工艺流程中,苯、氧化钙、氢氧化钠、二氧化碳4种物质均可以循环使用,理论上应当没有消耗。
(2)检验污水中有无苯酚,用简单而又现象明显的方法可利用苯酚的显色反应性质,即,先取污水与试管中,向试管中滴加FeCl3溶液,若溶液呈紫色,则表明污水中含有苯酚,反之,则表明没有苯酚。
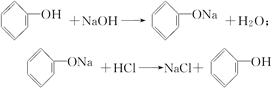
(3)从废水中回收苯酚,主要是利用了苯酚的弱酸性及在水中溶解度比较小的性质,先加碱性物质,如NaOH或
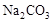 ,生成易容与水的苯酚钠,然后分液后,在水层中加入酸性物质,如盐酸或碳酸均可,发生反应如下:
,生成易容与水的苯酚钠,然后分液后,在水层中加入酸性物质,如盐酸或碳酸均可,发生反应如下: ,
,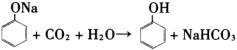 。
。
练习册系列答案
相关题目
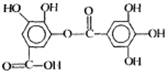
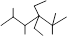 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷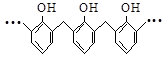 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛