题目内容
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)该溶液中各离子浓度大小关系为:_______________________
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=110-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为110-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式
(1)H2
(2)3NO2+H2O=2H++2NO3-+NO
(3)4NH3+6NO=5N2+6H2O
(4)酸 c(Cl-) >c(NH4+) >c(H+) >c(OH-)
(5)ACD(漏选得1分,错选得0分,答全得2分)
(6)3NO===NO2+N2O
【解析】略

【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
形
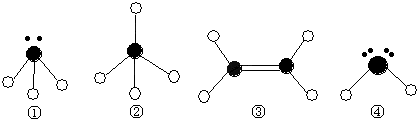
(2)某同学根据上述信息,所画的B电子排布图如图

违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
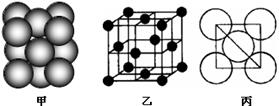
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
⑵某同学根据上述信息,所画的B电子排布图如图
 ,违背了 原理。
,违背了 原理。⑶F位于 族 区,其基态原子有 种运动状态。
⑷CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 ,检验E元素的方法是 。
⑸若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。

【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素原子的核外p电子总数比s电子总数少1 |
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
|
C原子核外所有p轨道全满或半满 |
|
D元素的主族序数与周期数的差为4 |
|
E是前四周期中电负性最小的元素 |
|
F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形
(2)某同学根据上述信息,所画的B电子排布图如图
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .