题目内容
(2011?崇明县二模)在一定温度下,向一个容积不变的容器中,加入2mol N2和8mol H2及固体催化剂,使之反应,平衡时容器内气体压强为起始时的80%,该反应的热化学方程式为:N2(g)+3H2(g)→2NH3(g)+92kJ.下列叙述中正确的是( )
分析:利用三段式计算:
N2(g)+3H2(g)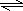 2NH3(g)
2NH3(g)
起始:2mol 8mol 0
转化:x 3x 2x
平衡:2-x 8-3x 2x
根据压强之比等于物质的量之比,则有:(2-x+6-3x+2x)÷(2+8)=0.8,解之得x=1,以此计算转化率和反应放出的热量.
N2(g)+3H2(g)
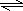 2NH3(g)
2NH3(g)起始:2mol 8mol 0
转化:x 3x 2x
平衡:2-x 8-3x 2x
根据压强之比等于物质的量之比,则有:(2-x+6-3x+2x)÷(2+8)=0.8,解之得x=1,以此计算转化率和反应放出的热量.
解答:解:利用三段式计算:
N2(g)+3H2(g)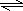 2NH3(g)
2NH3(g)
起始:2mol 8mol 0
转化:x 3x 2x
平衡:2-x 8-3x 2x
根据压强之比等于物质的量之比,则有:(2-x+6-3x+2x)÷(2+8)=0.8,解之得x=1,
则NH3的物质的量为2mol,则NH3的体积分数为
× 100%=
×100%=25%,
由热化学反应方程式可知此时反应的氮气为1mol,所以放出的热量等于92.2kJ,
故选B.
N2(g)+3H2(g)
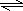 2NH3(g)
2NH3(g)起始:2mol 8mol 0
转化:x 3x 2x
平衡:2-x 8-3x 2x
根据压强之比等于物质的量之比,则有:(2-x+6-3x+2x)÷(2+8)=0.8,解之得x=1,
则NH3的物质的量为2mol,则NH3的体积分数为
| 2x |
| (2-x+6-3x+2x) |
| 2 |
| 8 |
由热化学反应方程式可知此时反应的氮气为1mol,所以放出的热量等于92.2kJ,
故选B.
点评:本题考查化学平衡和反应热的计算,题目难度不大,注意做题时利用三段式法计算,思路清晰、明朗.

练习册系列答案
相关题目






 (2011?崇明县二模)取等物质量浓度的NaOH 溶液两份甲和乙各100mL,分别向甲、乙中通入不等量的CO2,然后向两溶液中逐滴加入2mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸溶液的体积之间关系如图所示,试回答下列问题:
(2011?崇明县二模)取等物质量浓度的NaOH 溶液两份甲和乙各100mL,分别向甲、乙中通入不等量的CO2,然后向两溶液中逐滴加入2mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸溶液的体积之间关系如图所示,试回答下列问题: