题目内容
在一个容积为5L的密闭容器中,通入NH3和O2,它们的物质的量之比为1:2,发生如下反应:4NH3+5O2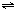 4NO+6H2O(g).
4NO+6H2O(g).
(1)上述反应在一定条件下2min后达到平衡,含NH32mol,已知NH3的转化率20%,若以NO浓度变化表示该反应的平均反应速率为
(2)在达到平衡后,加入相当于原组成气体1倍的惰性气体,如果容器的容积不变,则平衡
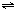 4NO+6H2O(g).
4NO+6H2O(g).(1)上述反应在一定条件下2min后达到平衡,含NH32mol,已知NH3的转化率20%,若以NO浓度变化表示该反应的平均反应速率为
0.05mol/(L?min)
0.05mol/(L?min)
,O2的平衡浓度为0.875 mol/L
0.875 mol/L
.(2)在达到平衡后,加入相当于原组成气体1倍的惰性气体,如果容器的容积不变,则平衡
不
不
移动;如果保持总压强不变,则平衡向右
向右
移动.分析:(1)根据三段式解题法,令开始通入的氨气的物质的量为nmol,表示出反应混合物各组分物质的量的变化量、平衡时各组分的物质的量,根据v=
计算v(NO);O2的平衡浓度为起始浓度减去浓度变化量.
(2)容积不变,加入惰性气体,反应混合物各组分的浓度不变,平衡不移动;
总压强不变,容器容积增大,等效为减小压强,平衡向体积增大的方向移动.
| △c |
| △t |
(2)容积不变,加入惰性气体,反应混合物各组分的浓度不变,平衡不移动;
总压强不变,容器容积增大,等效为减小压强,平衡向体积增大的方向移动.
解答:解:(1)根据三段式解题法,表示出反应混合物各组分物质的量的变化量、平衡时各组分的物质的量.
令开始通入的氨气的物质的量为nmol,则
4NH3 +5O2 4NO+6H2O,
4NO+6H2O,
开始(mol):n 2n 0 0
变化(mol):0.2n 0.25n 0.2n 0.3n
平衡(mol):0.8n 1.75n 0.2n 0.3n
所以0.8n=2,解得n=2.5
以NO表示的平均反应速率为v(NO)=
=0.05mol/(L?min).
O2的平衡浓度为
=0.875mol/L.
故答案为:0.05mol/(L?min);0.875mol/L
(2)容积不变,加入惰性气体,反应混合物各组分的浓度不变,平衡不移动;
总压强不变,容器容积增大,等效为减小压强,平衡向体积增大的方向移动,即向右移动.
故答案为:不;向右
令开始通入的氨气的物质的量为nmol,则
4NH3 +5O2
 4NO+6H2O,
4NO+6H2O,开始(mol):n 2n 0 0
变化(mol):0.2n 0.25n 0.2n 0.3n
平衡(mol):0.8n 1.75n 0.2n 0.3n
所以0.8n=2,解得n=2.5
以NO表示的平均反应速率为v(NO)=
| ||
| 2min |
O2的平衡浓度为
| 2.5mol×1.75 |
| 5L |
故答案为:0.05mol/(L?min);0.875mol/L
(2)容积不变,加入惰性气体,反应混合物各组分的浓度不变,平衡不移动;
总压强不变,容器容积增大,等效为减小压强,平衡向体积增大的方向移动,即向右移动.
故答案为:不;向右
点评:考查化学平衡计算、影响因素,难度不大.注意惰性气体加入对平衡的影响,先分析对反应混合物浓度的影响,再等效为压强的影响.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
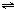
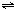 4NO+6H2O(g).
4NO+6H2O(g).