题目内容
(14分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
(1) f元素在周期表中的位置是第 周期第 族。
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
| a | | | |||||
| | | | b | c | d | | |
| e | | f | | | g | | |
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
(每空2分,共14分)(1) 3 IIIA (4分) (2)NaOH+Al(OH)3=NaAlO2+2H2O (2分)
(3) 离子键、共价键 (4分) (4)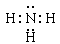 (2分) H2O(2分)
(2分) H2O(2分)
(3) 离子键、共价键 (4分) (4)
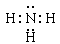 (2分) H2O(2分)
(2分) H2O(2分)考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可判断,a~g分别是H、C、N、O、Na、Al、S。
(1)铝元素位于第三周期第ⅢA。
(2)氢氧化铝是两性氢氧化物,能和氢氧化钠反应,方程式为NaOH+Al(OH)3=NaAlO2+2H2O。
(3)钠在空气中的燃烧产物是过氧化钠,其中含有离子键和非极性键。
(4)氨气是含有极性键的共价化合物,电子式为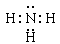 。同周期自左向右非金属性逐渐增强,相应氢化物的稳定性也逐渐增强,所以水的稳定性要强于氨气的
。同周期自左向右非金属性逐渐增强,相应氢化物的稳定性也逐渐增强,所以水的稳定性要强于氨气的
(1)铝元素位于第三周期第ⅢA。
(2)氢氧化铝是两性氢氧化物,能和氢氧化钠反应,方程式为NaOH+Al(OH)3=NaAlO2+2H2O。
(3)钠在空气中的燃烧产物是过氧化钠,其中含有离子键和非极性键。
(4)氨气是含有极性键的共价化合物,电子式为
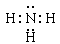 。同周期自左向右非金属性逐渐增强,相应氢化物的稳定性也逐渐增强,所以水的稳定性要强于氨气的
。同周期自左向右非金属性逐渐增强,相应氢化物的稳定性也逐渐增强,所以水的稳定性要强于氨气的
练习册系列答案
相关题目
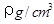 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为 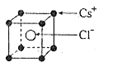
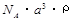 g/mol B.
g/mol B.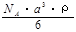 g/mol
g/mol 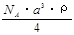 g/mol D.
g/mol D.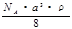 g/mol
g/mol
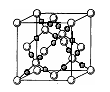
 A.C、D气态氢化物稳定性强弱和沸点高低均为C>D
A.C、D气态氢化物稳定性强弱和沸点高低均为C>D 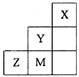
 Rn),该原子核内的中子数是
Rn),该原子核内的中子数是