题目内容
NA代表阿伏加德罗常数,下列叙述正确的是
- A.10ml质量分数为98%的H2SO4,用水稀释至100ml,H2SO4的质量分数为9.8%
- B.1摩尔氯化铁制成氢氧化铁胶体,胶体微粒数目为NA
- C.常温常压下,氧气和臭氧的混合物16g中含有NA个氧原子
- D.一定温度下,1L0.5mol?L-1NH4Cl溶液与2L0.25mol?L-1NH4Cl溶液含NH4+物质的量相同
C
分析:A、硫酸密度大于水,加水稀释时密度改变,浓度越小密度越小,以此进行分析;
B、Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒;
C、O2和O3都由O原子组成,即氧原子的质量为16g,以此计算;
D、NH4Cl溶液中铵根离子水解,溶液浓度不同水解程度不同,溶液浓度越小,水解程度越大.
解答:A、硫酸密度大于水,加水稀释时密度改变,浓度越小密度越小,10ml质量分数为98%的H2SO4,用水稀释至100ml,H2SO4的质量分数约为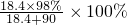 =16.6%,大于9.8%,故A错误;
=16.6%,大于9.8%,故A错误;
B、Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒,1molFeCl3完全水解,产生Fe(OH)3胶体粒子小于6.02×1023,故B错误;
C、O2和O3都由O原子组成,则16gO2和O3混合气体中氧原子总数为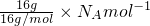 =1NA,故C正确;
=1NA,故C正确;
D、NH4Cl溶液中铵根离子水解,溶液浓度不同水解程度不同,溶液浓度越小,水解程度越大,则1L0.5mol?L-1NH4Cl溶液NH4+物质的量大于与2L0.25mol?L-1NH4Cl溶液NH4+物质的量,故D错误.
故选C.
点评:本题考查阿伏加德罗常数,题目难度不大,做题时注意物质的组成、结构、性质以及存在的状态和条件等问题,本题此错点为A项.
分析:A、硫酸密度大于水,加水稀释时密度改变,浓度越小密度越小,以此进行分析;
B、Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒;
C、O2和O3都由O原子组成,即氧原子的质量为16g,以此计算;
D、NH4Cl溶液中铵根离子水解,溶液浓度不同水解程度不同,溶液浓度越小,水解程度越大.
解答:A、硫酸密度大于水,加水稀释时密度改变,浓度越小密度越小,10ml质量分数为98%的H2SO4,用水稀释至100ml,H2SO4的质量分数约为
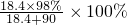 =16.6%,大于9.8%,故A错误;
=16.6%,大于9.8%,故A错误;B、Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒,1molFeCl3完全水解,产生Fe(OH)3胶体粒子小于6.02×1023,故B错误;
C、O2和O3都由O原子组成,则16gO2和O3混合气体中氧原子总数为
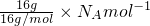 =1NA,故C正确;
=1NA,故C正确;D、NH4Cl溶液中铵根离子水解,溶液浓度不同水解程度不同,溶液浓度越小,水解程度越大,则1L0.5mol?L-1NH4Cl溶液NH4+物质的量大于与2L0.25mol?L-1NH4Cl溶液NH4+物质的量,故D错误.
故选C.
点评:本题考查阿伏加德罗常数,题目难度不大,做题时注意物质的组成、结构、性质以及存在的状态和条件等问题,本题此错点为A项.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目