题目内容
3.已知分解1mol H2O2放出热量98KJ.在含有少量I-的溶液中,H2O2分解的机理为:①H2O2+I-=H2O+IO-(慢)②H2O2+IO-=H2O+O2+I-(快)下列有关该反应的说法正确的是( )| A. | 反应速率与I-浓度有关 | B. | IO-也是该反应的催化剂 | ||
| C. | 该化学反应速率由反应②决定 | D. | v(H2O2)=v(H2O)=v(O2) |
分析 A、反应速率的快慢主要决定于反应速率慢的第一步反应;
B、反应的催化剂是I-;
C、若总反应由一系列快慢悬殊的连续步骤组成,总反应速率就决定于其中最慢的一步;
D、在一个化学反应中,用各物质表示的速率之比等于化学计量数之比.
解答 解:A、已知:①H2O2+I-→H2O+IO- 慢 ②H2O2+IO-→H2O+O2+I- 快,过氧化氢分解快慢决定于反应慢的①,I-是①的反应物之一,其浓度大小对反应不可能没有影响,例如,其浓度为0时反应不能发生,故A正确;
B、将反应①+②可得总反应方程式,反应的催化剂是I-,IO-只是中间产物,故B错误;
C、若总反应由一系列快慢悬殊的连续步骤组成,总反应速率就决定于其中最慢的一步,所以总反应的速率主要取决于反应中的①,故C错误;
D、因为反应是在含少量I-的溶液中进行的,溶液中水的浓度是常数,不能用其浓度变化表示反应速率,故D错误;
故选A.
点评 本题目主要考查催化剂、活化能、化学反应速率的相关知识,题目难度不大.

练习册系列答案
相关题目
14.下列各组有机物,只用溴水就能鉴别的是( )
| A. | 己烯 苯 四氯化碳 | B. | 苯 己烯 己炔 | ||
| C. | 苯 己烷 己炔 | D. | 溴己烷 苯 己烯 |
18.下列物质中:互为同分异构体的是( )
| A. | 液氯、氯气 | B. | CH2=CH-CH3 CH3-CH2-CH3 | ||
| C. | N2、CO | D. | 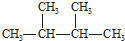 、 、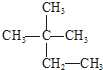 |
8.下列烷烃的一氯代物中没有同分异构体的是( )
| A. | 2,2-二甲基丙烷 | B. | 2-甲基丙烷 | C. | 丙烷 | D. | 丁烷 |
15.在原电池的电极上所发生的反应,下列说法正确的是( )
| A. | 原电池的正极发生氧化反应 | |
| B. | 原电池的负极发生氧化反应 | |
| C. | 发生原电池反应时,溶液中的阳离子向负极定向移动 | |
| D. | 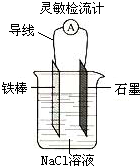 如图,可观察到灵敏检流计的指针不偏转 |
12.下列晶体中不属于原子晶体的是( )
| A. | 干冰 | B. | 金刚砂 | C. | 金刚石 | D. | 水晶 |