题目内容
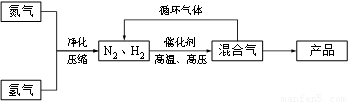
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下
 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下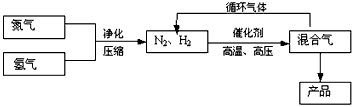
反应体系中各组分的部分性质见下表
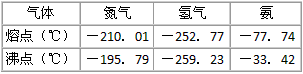
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。随着温度升高,K值___________(填增大、减小、不变)。
(2)平衡常数K值越大,表明___________(填序号)。
A.N2的转化率越高
B.NH3的产率越大
C.原料中N2的含量越高
D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到___________使___________分离出来;继续循环的气体是___________。
(1)写出该反应的化学平衡常数表达式:K=___________。随着温度升高,K值___________(填增大、减小、不变)。
(2)平衡常数K值越大,表明___________(填序号)。
A.N2的转化率越高
B.NH3的产率越大
C.原料中N2的含量越高
D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到___________使___________分离出来;继续循环的气体是___________。
(1)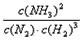 ;减小
;减小
(2)AB
(3)-33.42℃;氨;N2、H2
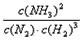 ;减小
;减小(2)AB
(3)-33.42℃;氨;N2、H2

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目



 2NO(g) ΔH
2NO(g) ΔH ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。 2NH3(g)回答下列问题:
2NH3(g)回答下列问题: )+c(
)+c( )+c(H2SO3)]=c(
)+c(H2SO3)]=c( )+c(NH3·H2O)
)+c(NH3·H2O)