题目内容
(Ⅰ)(8分)某无色溶液中可能含有Na+、SO42—
、MnO4—、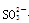 、Cl— 、Br—、中的若干种,依次进行下列实验。观察到现象如下:
、Cl— 、Br—、中的若干种,依次进行下列实验。观察到现象如下:
①用pH试纸检验,溶液pH>7;
②向溶液中滴加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;
③向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
④另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
回答下列问题:
(1)溶液中肯定含有的离子是 ;肯定没有的离子是 。
⑵写出步骤②中的离子方程式 。
(Ⅱ)(6分)SO2气体通入滴有酚酞的NaOH溶液,红色逐渐褪去,可能的原因:
① ② 。
简述设计实验证明: 。
(Ⅰ).(8分)⑴Na+ 、Br—、
 、MnO4—
、MnO4—
⑵Cl2+2Br—== Br2+2 Cl—  +Cl2+H2O ==2H++2Cl—+SO42—
+Cl2+H2O ==2H++2Cl—+SO42—
(Ⅱ).(6分)
①假设一:SO2或SO2与水作用的产物漂白了红色的溶液;
②假设二:SO2与NaOH反应降低了溶液的PH(答消耗NaOH,碱性减弱均可)
方案一、取上述褪色后的溶液于试管,加入NaOH溶液,溶液恢复红色,则假设二成立;
方案二、取上述褪色后的溶液于试管,用酒精灯加热,溶液恢复红色,,则假设一成立
【解析】
试题分析:此题的做法是一边做,一变分析,判断,具体做法如下:
某无色溶液肯定没有MnO4—(紫色)中可能含有Na+(肯定有,因为只有它一种阳离子)、SO42— 、MnO4—肯定没有MnO4—(紫色)、 、Cl— 、Br—、中的若干种,依次进行下列实验。观察到现象如下:
、Cl— 、Br—、中的若干种,依次进行下列实验。观察到现象如下:
①用pH试纸检验,溶液pH>7;说明溶液呈现碱性,所以在碱性环境中不能大量共存的离子不能存在,此处不能排除任何离子;
②向溶液中滴加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;说明一定有Br—离子,因为溴单质溶于四氯化碳后是橙红色的;
③向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。判断不出是不是有氯离子,因为前面加的是氯水,其中含有氯离子,对实验是有干扰的。只能说可能有氯离子。
④另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。肯定有亚硫酸根,溶液中的硝酸根和氢离子把它氧化成了硫酸根了,所以一定有亚硫酸根。所以溶液中肯定含有的离子是Na+ 、Br—、
 ;肯定没有的离子是MnO4— ;步骤②中的离子方程式是Cl2+2Br—==
Br2+2 Cl—;
;肯定没有的离子是MnO4— ;步骤②中的离子方程式是Cl2+2Br—==
Br2+2 Cl—; +Cl2+H2O
==2H++2Cl—+SO42—;SO2气体通入滴有酚酞的NaOH溶液,红色逐渐褪去,可能的原因:
+Cl2+H2O
==2H++2Cl—+SO42—;SO2气体通入滴有酚酞的NaOH溶液,红色逐渐褪去,可能的原因:
SO2或SO2与水作用的产物漂白了红色的溶液;SO2与NaOH反应降低了溶液的PH;
设计实验证明的方法:方案一、取上述褪色后的溶液于试管,加入NaOH溶液,溶液恢复红色,则假设二成立;
方案二、取上述褪色后的溶液于试管,用酒精灯加热,溶液恢复红色,,则假设一成立。
考点:化学实验
点评:离子推断题解法归纳:这些推断题的解法在于掌握离子的特有反应以及离子间的共存情况。在解题之前,应对所提供的离子在溶液中能否大量共存进行分析,做到心中有数。一般来说,离子间能生成沉淀、或气体、或弱电解质,以及能发生氧化还原反应的,就不能在溶液中大量共存。例如,H+与OH- ,H+与弱酸根阴离子,OH- 与弱碱阳离子,Ag+与Cl- 、Br- 、I- 、 、
、 ,Ba2+、Ca2+与
,Ba2+、Ca2+与 、
、 ,Fe2+与
,Fe2+与 (酸性条件下),Fe3+与S2- ,Al3+与
(酸性条件下),Fe3+与S2- ,Al3+与 、S2- 等等,都不能在溶液中共存。
、S2- 等等,都不能在溶液中共存。
在具体推断过程中,要注意以下几点:
(1) 把推断离子的肯定与否定存在结合起来考虑,不要单打一。
(2) 推断过程中,前后的结论不应该矛盾。因此,前面已下结论的离子,在后面的推断过程中可不再重叙。若在分析中发现前后结论有矛盾,则应找出错误原因。
(3) 在作推断结果时,应该考虑三个方面,即肯定存在的离子,肯定不存在的离子,不能判定存在与否的离子。并且这三个方面的离子应是互相独立的,任何一种离子只能出现一次,不能重复出现。当然有的题目中不一定三种情况都需要回答,但分析问题时都应该考虑到。

在某无色溶液中可大量共存的离子组是
| A.Ba2+、NO3-、SO32-、Cl- | B.K+、Cl-、SiO32-、H+ |
| C.K+、SO32-、CO32-、OH- | D.Cu2+、NO3-、SO42-、Cl- |