题目内容
(10分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如 :
:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式 ;
(2)CCl4分子中C原子采取 杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号):
(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ?mol-1、NaCl-786kJ?mol-1。导致两者晶格能差异的主要原因是 。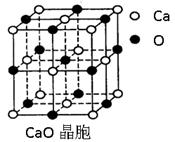
 :
:Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式 ;
(2)CCl4分子中C原子采取 杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是
 (填序号):
(填序号):a.2个σ键 b.2个π键 c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ?mol-1、NaCl-786kJ?mol-1。导致两者晶格能差异的主要原因是 。

(1)1s22s22p63s23p63d3 (2)sp3 (3)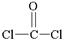 c
c
(4) 6 CaO晶体中离子的电荷数大于NaCl
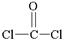 c
c(4) 6 CaO晶体中离子的电荷数大于NaCl
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目