题目内容
(14分) 现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 c(OH-) / c(NH3·H2O) ______ (填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
_____________________________________________________________________;
所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因:
_________________ 。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=________;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是______________________________________。
1)减小(2分)
(2)NH3·H2O+H+="=" NH4++H2O(2分) <(2分)
NH4++H2O NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
(3)  mol·L-1(2分)
mol·L-1(2分)
(4)c(NH4+)>c(SO42-)>c(H+)>c(OH-)(2分)
【解析】
试题分析:(1)氨水为弱碱,电离方程式为NH3.H2O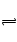 NH4++OH-,加入硫酸铵固体,增加了NH4+的浓度,反应向逆反应方向进行,但加入NH4+的浓度远远大于向逆反应方向消耗掉的NH4+,故c(OH-) /
c(NH3·H2O)变小。
NH4++OH-,加入硫酸铵固体,增加了NH4+的浓度,反应向逆反应方向进行,但加入NH4+的浓度远远大于向逆反应方向消耗掉的NH4+,故c(OH-) /
c(NH3·H2O)变小。
(2)氨水为弱电解质,加入强电解质稀硫酸,恰好完全反应,说明是酸碱中和完全,生成的是强酸弱碱盐,会发生水解,NH4++H2O NH3·H2O+H+,故溶液显酸性,PH<7。
NH3·H2O+H+,故溶液显酸性,PH<7。
(3)[H+]+[NH4+]=[OH-]+2[SO42-],而pH=7,即[H+]=[OH-],所以硫酸根浓度时铵根浓度的一半。即a/2。
(4)生成的硫酸铵,为强酸弱碱盐,故溶液显酸性,又因NH4+会发生水解,但只是少量一部分,综上有c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
考点:弱酸弱碱。。
点评:此题考核了弱酸弱碱盐的电离和水解,以及电荷守恒、物料守恒、质子守恒等知识点。
