题目内容
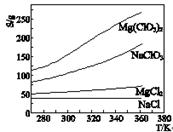
已知四种盐的溶解度(S)曲线如右图所示,下列说法不正确的是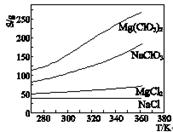
| A.将NaCl溶液蒸干可得NaCl固体 |
| B.将MgCl2溶液蒸干可得MgCl2固体 |
| C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 |
| D.可用MgCl2和NaClO3制备Mg (ClO3)2 |
B
解析试题分析:NaCl的溶解度随温度变化很小,而且NaCl是强酸强碱盐,不水解,所以将溶液蒸干可得NaCl固体;MgCl2是强碱弱酸盐,盐酸很容易挥发,将MgCl2溶液蒸干只能得到Mg(OH)2 固体;所以B错;Mg(ClO3)2的溶解度随温度变化很大,而NaCl的溶解度随温度变化很小,所以Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯;MgCl2和NaClO3的溶解度随温度变化都没有Mg (ClO3)2大,所以可以在高温下将MgCl2和NaClO3配成饱和溶液,然后迅速降温即可制备Mg (ClO3)2。故选B。
考点:识图能力数据分析能力
点评:从图像中所给出的数据分析综合,处理数据,解决问题是最近几年高考的热点。

练习册系列答案
相关题目
已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是( )
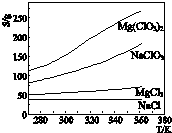

| A、将MgCl2溶液蒸干后不可能得到MgCl2固体 | B、将NaCl溶液蒸干可得NaOH固体 | C、NaClO3中混有少量NaCl杂质,可用重结晶法提纯 | D、可用MgCl2和NaClO3制备Mg(ClO3)2 |
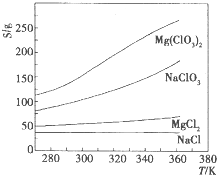 已知四种盐的溶解度(s)曲线如图所示,下列说法不正确的是( )
已知四种盐的溶解度(s)曲线如图所示,下列说法不正确的是( )